Sujet 0 série S 2013
L'anesthésie des prémices à nos jours
|
William Morton (1819-1868) |
Pendant longtemps la chirurgie a été confrontée au problème de la douleur des patients. Ne disposant d’aucun produit permettant de la soulager, le médecin ne pouvait pratiquer une opération « à vif » du patient.
|
Données :
|
Composé |
Éthanol |
Éther diéthylique ou Ether |
Eau |
Éthylène ou Ethène |
|
Formule brute |
C2H6O |
C4H10O |
H2O |
C2H4 |
|
Température d’ébullition sous une pression de 1 bar (en°C ) |
78 |
35 |
100 |
-104 |
|
Masse molaire (g.mol-1) |
46 |
74 |
18 |
28 |
Ø Masse volumique d’une solution aqueuse d’hydroxyde de sodium : r = 1,0 g.mL-1 ;
Ø Masse volumique de l’éthanol : réthanol = 0,81 g.mL-1 ;
Ø Masse volumique de l’éther diéthylique : réther = 0,71 g.mL-1 ;
Ø L’eau et l’éther ne sont pas miscibles ;
Ø La température du laboratoire est de 20°C.
Partie A :
Synthèse de l’éther diéthylique
1. Choix d’un protocole
La synthèse de l’éther diéthylique peut se faire par déshydratation de l’éthanol. Cependant selon les conditions opératoires choisies, la déshydratation peut aboutir à deux produits différents.
Les deux équations de réaction correspondantes sont les suivantes :
CH3-CH2-OH →
CH2=CH2 + H2O
2 CH3-CH2-OH
→ CH3-CH2-O-CH2-CH3 + H2O
La température joue un rôle important dans l’orientation de la réaction : une température moyenne favorise la formation de l’éther diéthylique, une température élevée celle de l’éthylène.
On étudie deux protocoles possibles de déshydratation :
Conditions opératoires 1 : on fait passer à 300°C des vapeurs d’éthanol sur de l’alumine ;
Conditions opératoires 2 : on chauffe l’éthanol à 140°C en présence d’un acide fort.
Compléter le tableau donné en annexe.
2. Analyse du protocole retenu
|
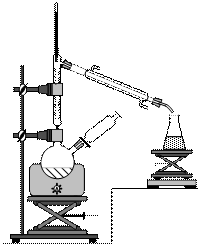
Pour synthétiser l’éther diéthylique, on suit le protocole expérimental suivant : - réaliser un montage de distillation fractionnée dans lequel un ballon bicol supporte une colonne à distiller ainsi qu’une ampoule de coulée ; - verser 25 mL d’éthanol dans le ballon et placer dans l’ampoule de coulée 10 mL d’un acide fort, l’acide sulfurique concentré ; - sous agitation, verser goutte à goutte l’acide sulfurique dans le mélange, puis chauffer ; - récupérer le distillat lorsque la température en tête de colonne est à 35°C ; - verser le distillat dans une ampoule à décanter, ajouter une solution aqueuse d’hydroxyde de sodium Na+(aq) + HO-(aq) ; - récupérer la phase contenant l’éther diéthylique. |
|
2.1. Pourquoi faut-il mettre l’erlenmeyer de récupération du distillat dans un bain de glace ?
2.2. Malgré les précautions prises, la formation d’éthylène peut avoir lieu de façon minoritaire mais pour autant on ne le trouve pas dans le distillat. À l’aide des données, proposer une explication.
2.3. Calculer la quantité de matière d’éthanol introduite dans le ballon et la masse attendue d’éther diéthylique.
2.4. Le distillat obtenu présente un caractère acide. Quelle étape du protocole permet d’éliminer les traces acides du distillat ? Justifier.
2.5. Où se trouve l’éther diéthylique dans l’ampoule à décanter ? Justifier.
3. Étude du mécanisme de
la synthèse de l’éther diéthylique
Le mécanisme réactionnel proposé pour la réaction de déshydratation conduisant à l’éther diéthylique est proposé ci-dessous. Il comporte trois étapes.
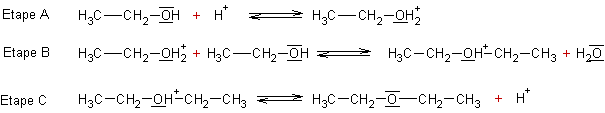
3.1. À l’aide de vos connaissances sur les sites donneurs et accepteurs de doublets d’électrons, expliquer l’étape (a) du mécanisme.
3.2. Recopier l’équation de l’étape (a) et faire apparaître la flèche courbe schématisant le transfert électronique.
3.3. En observant les équations des étapes (a) et (c), justifier que l’acide sulfurique n’est pas un réactif dans cette synthèse. Quel peut alors être son rôle dans la synthèse ?
4. Techniques d’analyse des espèces chimiques intervenant dans la réaction
Les techniques utilisées sont la spectroscopie infrarouge IR
et la spectrométrie RMN du proton.
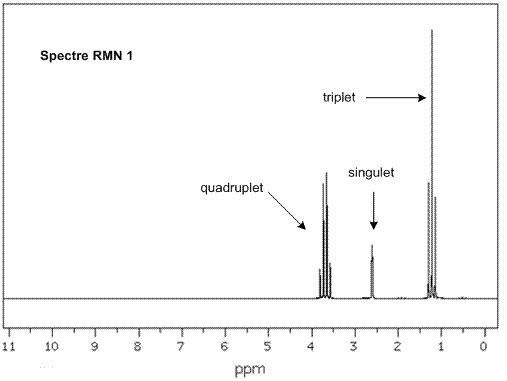
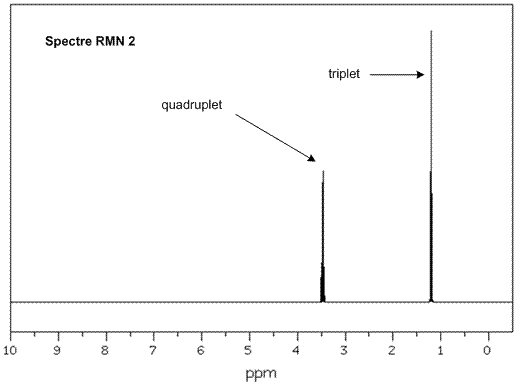
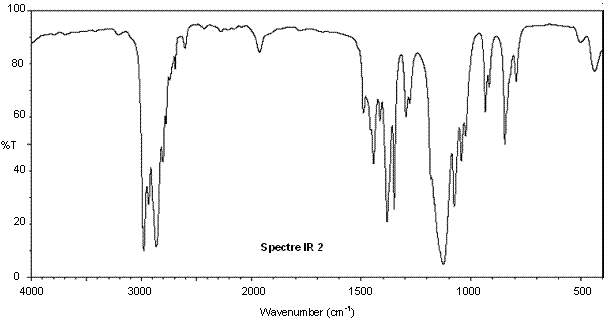
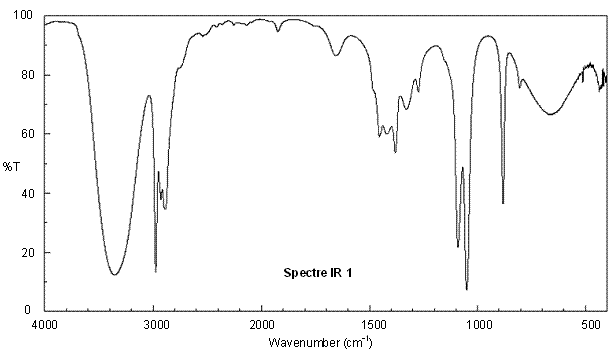
On donne en annexe deux spectres RMN du proton et deux spectres infrarouge (IR) correspondant à l’éther diéthylique et à l’éthanol ainsi qu’une table de données de spectroscopie infrarouge IR.
Associer chaque spectre infrarouge IR et RMN à la molécule correspondante en justifiant.
Attribuer un signal en RMN
à chaque groupe de protons chimiquement équivalents et justifier sa
multiplicité pour chacun des signaux.
Partie B : Un
remplaçant de l’éther diéthylique
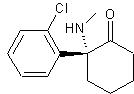
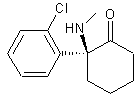
À l’heure actuelle, du fait de son extrême inflammabilité, de ses nombreux effets secondaires, de sa toxicité ainsi que du risque élevé de dépendance qu’il entraîne, l’éther diéthylique n’est pratiquement plus utilisé comme anesthésiant, et d’autres molécules beaucoup plus spécifiques l’ont remplacé. C’est le cas par exemple de la kétamine, qui contient un mélange équimolaire des deux molécules ci-dessous.
|
|
|
|
Molécule A |
Molécule A’ |
5. Etude des molécules de la kétamine
5.1. Reproduire la formule topologique de la molécule A. Entourer et identifier les groupes caractéristiques présents dans cette molécule.
5.2. Quelle est la différence entre les molécules A et A’ ?
6. Utilisation médicale de la kétamine
Du fait de son action rapide, la kétamine est principalement utilisée en médecine d’urgence. Elle est le plus souvent administrée via une injection intraveineuse unique avec une dose de l’ordre de 2 mg par kg de corps humain et sa demi-vie d’élimination est de 2 à 4 heures.
6.1. Par analogie avec le temps de demi-réaction défini en cinétique chimique, proposer une définition au terme de « demi-vie d’élimination » donné dans le texte.
Annexes :
Annexe 1 : Spectres RMN de l'éthanol et de l'éther diéthylique
Annexe 2 : Spectres IR de l'éthanol et de l'éther diéthylique
Annexe 3 : Tableau de données de spectroscopie IR