EXERCICE 186
Synthèse de la
vitamine A1
Les trois parties de
cet exercice sont indépendantes.
La vitamine A1, aussi appelée rétinol,
joue un rôle déterminant dans le mécanisme de la vision. Elle est également
impliquée dans de nombreuses fonctions de l'organisme.
La vitamine A1 utilisée pour pallier
des carences est essentiellement obtenue par voie de synthèse, même si on la
trouve dans de nombreux aliments. Cette synthèse met en jeu deux molécules
odorantes : le citral et l’ionone. Le schéma de synthèse simplifié est le
suivant :
Citral →
ionone → rétinol
Cet exercice étudie cette synthèse
multi-étapes.
1.
Le citral
Le citral est le nom donné à deux
molécules isomères : le géranial [A] (ou α-citral) et le néral
[B] (ou β-citral) dont les formules topologiques sont
données ci-dessous.

Le géranial et le néral sont présents
dans les huiles essentielles de citron et de verveine et sont donc utilisés en
parfumerie et en tant qu’arômes alimentaires.
1.1.
Donner le nom du citral en utilisant les règles de la nomenclature officielle.
1.2.
Préciser la stéréochimie de la (ou des) double(s) liaison(s) C=C dans la
molécule de α-citral et dans la molécule de β-citral.
Justifier.
1.3.
Quelle relation d’isomérie existe-t-il entre le α-citral et le β-citral
? Justifier la réponse.
1.4.
On réalise une mesure polarimétrique sur une solution de α-citral.
Quel est le pouvoir rotatoire observé ? Justifier la réponse.
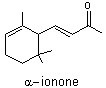
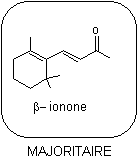
2.
Synthèse de l’ionone à partir du citral
L’ionone est un liquide jaune pâle (à
température ambiante) composé de deux isomères : l' α-Ionone
et la β-ionone.
La synthèse de l’ionone à partir du
citral a été réalisée pour la première fois en 1893 par Ferdinand Tiemann
(1848–1899).
La première étape de cette synthèse
consiste en une réaction d’aldolisation croisée entre le α-
citral [A] et l’acétone (ou propanone) en milieu basique (Na+ + HO−).
L’analyse du milieu réactionnel met en évidence un nouveau composé [C], qui se
déshydrate en un composé [D], appelé pseudo-ionone.
Le composé [D] subit ensuite une
réaction de cyclisation (qui ne sera pas étudiée ici) pour conduire à un
mélange de α-ionone (minoritaire) et de β-ionone
(majoritaire).
|
|
|
2.1.
Indiquer, dans un tableau en annexe, les formules semi-développées des
molécules [C] et [D].
2.2.
Détailler le mécanisme de la réaction d’aldolisation qui conduit à la formation
de [C].
2.3.
Quelle particularité structurale pourrait expliquer que la β-ionone
est obtenue majoritairement par rapport à la α-ionone ?
3.
Synthèse de la vitamine A1 à partir de la β-ionone
Le chlorure de vinyle CH2=CHCl
est traité par le magnésium métallique dans l’éther diéthylique anhydre. On
observe la formation d’un composé [E], sur lequel on fait agir la β-ionone.
Après hydrolyse acide et purification, on isole le composé [F] qui donne un
test négatif à la 2,4-DNPH.
En présence de bromure d’hydrogène, le
composé [F] précédemment obtenu conduit à la formation du composé [G]
représenté ci−dessous (étape non étudiée) :
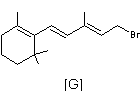
Le composé [G] est mis en présence de
triphénylphosphine P(C6H5)3 dans le
dichlorométhane pour conduire au produit [H].
Le produit [H] est alors placé dans
une solution d’éthanolate de sodium (C2H5O−
+ Na+) dans l’éthanol, à laquelle on ajoute le composé ci-dessous :
![]()
La réaction fournit un composé
organique [I], de l’éthanol et un composé phosphoré.
Le produit [I] est alors soumis à
l’action de la potasse (K+ + HO−) dans un mélange
eau-éthanol à reflux, ce qui conduit à [J'] qui, après passage en milieu acide,
donne [J].
L’action du tétrahydruroaluminate de
lithium LiAlH4 conduit, après hydrolyse, au rétinol :
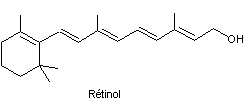
3.1.
Indiquer, dans un tableau en annexe, les formules semi-développées des composés
[E], [F], [H], [I] et [J].
3.2.
Étude de la réaction [E] → [F]
3.2.1.
Indiquer pourquoi l’éther diéthylique utilisé doit être anhydre. Écrire
l’équation de la réaction ainsi évitée.
3.2.2.
Qu’indique le test négatif à la 2,4-DNPH ?
3.3.
Étude de la réaction [H] → [I]
3.3.1.
Écrire l’équation de cette réaction ; on pourra utiliser des formules
simplifiées pour les molécules mises en jeu.
3.3.2.
Indiquer le nom de cette réaction.
3.4.
Étude de la réaction [I] → [J]
3.4.1.
Donner le mécanisme de la réaction [I] → [J'] ; on pourra
utiliser des formules simplifiées pour les molécules mises en jeu.
3.4.2.
Une hydrolyse acide de [I] conduirait directement à [J]. Expliquer pourquoi
l’hydrolyse acide conduirait à un rendement plus faible en [J].