LES NANOMEDICAMENTS
Gérard GOMEZ
Plan
de l'étude
2-1) Les
liposomes conventionnels
2-3) Liposomes
de 3ème génération
2-4) Les
principes actifs et les nanovecteurs
2-4-1) Des vecteurs de principes actifs hydrophiles
2-4-2) Des vecteurs de principes actifs lipophiles
2-4-3) Des vecteurs de principes actifs amphiphiles
3-1) Nanovecteurs
polymères de première génération
3-2) Nanovecteurs
polymères de deuxième génération
3-3) Nanovecteurs
polymères de troisième génération
3-4) Nanovecteurs
polymères de quatrième génération
Annexe 1 : Les phospholipides
Annexe 2 : Mode d'obtention de quelques polymères
Annexe 3 : Le polyéthylène glycol (PEG)
Pour
lutter contre les cellules tumorales, de nouveaux modes d'administration des
médicaments sont explorés.
Les
principes actifs sont connus mais la façon de les distribuer dans l'organisme
est nouvelle ; on les appelle des nanomédicaments.
- Avec un médicament classique, le
principe actif est envoyé en masse dans l'organisme en espérant qu'il atteindra
un maximum de cellules cancéreuses.
Une première
difficulté pour les molécules qui cheminent est qu'elles ont des
caractéristiques physico-chimiques, hydrophilie par exemple, peu favorables au
franchissement des barrières biologiques.
Un
second écueil est que ces molécules vont se heurter à des barrières
enzymatiques qui vont rapidement les dégrader.
Il faut
pallier ces déperditions ; on comprend dès lors pourquoi ce médicament est
envoyé en quantité importante.
Par
effet collatéral, des cellules saines voisines des cellules malades sont
également détruites et c'est l'effet toxique du remède qui s'avère parfois si
important qu'il oblige à arrêter le traitement.
- Les chercheurs mettent au point
des méthodes permettant de cibler les cellules à détruire et de leur envoyer
des molécules de principe actif qui les détruiront de façon sélective.
C'est
la mise au point de vecteurs submicroniques c'est-à-dire de taille inférieure
au micromètre (10-6 m) que l'on appelle des nanovecteurs, permettant
d'englober les molécules de principe actif, de les protéger de la dégradation
et de contrôler leur libération dans l'espace et dans le temps qui a permis de
créer ces nanomédicaments.
Ils
sont utilisés pour les traitements anti-tumoraux, comme on vient de le dire,
mais aussi pour des traitements antibiotiques, anti-asthmatiques, ….., en
thérapie génique ou en vaccination.
2)
Un exemple de nanovecteur :
Les
nanovecteurs utilisés sont de nature très variée ; on va décrire en détail les
liposomes et leur mode d'action.
Les
nanoliposomes
:
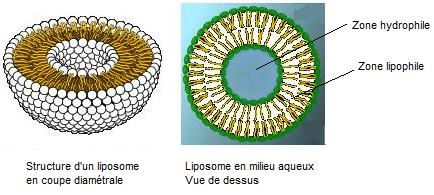
En
milieu aqueux les phospholipides naturels (voir annexe 1)
s'organisent spontanément en liposomes qui sont des poches sphériques à
l'intérieur desquelles on trouve, au centre une zone hydrophile remplie d'eau
et dans l'épaisseur une zone lipophile (hydrophobe) qui repousse l'eau.
On sait
par des procédés nanotechnologiques fabriquer de tels liposomes dont la taille
est de quelques nanomètres.
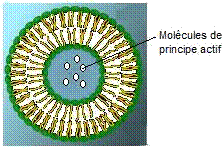
On
peut, à l'intérieur de ces vésicules, dans la phase aqueuse, dissoudre un
principe actif hydrophile.
2-1) Les liposomes
conventionnels (ou de 1ère génération)
Les
liposomes tels qu'ils viennent d'être décrits, sont appelés liposomes
conventionnels et n'ont qu'une durée de vie très courte une fois passés dans la
circulation sanguine ; ils sont en effet captés par les macrophages (des
cellules appartenant aux globules blancs, présentes dans les tissus et chargés
du nettoyage, en phagocytant un intrus dans l'organisme) et s'accumulent
essentiellement dans le foie ou dans la rate.
Dans le
cas des tumeurs du foie ces macrophages constituent alors un réservoir de
médicament ; une enzyme va détruire la couche superficielle des liposomes et le
principe actif va se déverser sur les tumeurs et jouer son rôle de médicament.
Mais si
l'on veut atteindre d'autres zones, il va falloir modifier ces nanovecteurs.
2-2) Les
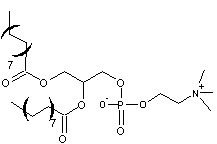
liposomes furtifs (ou de 2ème génération)
Afin
d'éviter qu'ils ne soient reconnus par le système immunitaire et phagocytés par
les macrophages les liposomes sont entourés d'un polymère hydrophile le P.E.G.
-polyéthylène glycol- (annexe 3) sous forme de
"filaments" qui, en maintenant par leur encombrement stérique les
systèmes de détection à distance du liposome, masquent sa présence.
Les
chaînes de polymère sont liées par liaison covalente aux phospholipides du
liposome ; on appelle alors ces ensembles des liposomes pégylés.
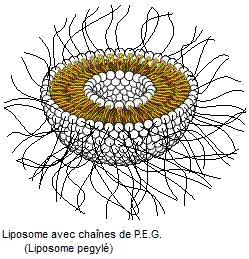
Les
liposomes ainsi protégés sont appelés liposomes furtifs ou de deuxième
génération.
Ils
continuent leur chemin dans la circulation sanguine (signalons qu'ils sont environ
70 fois plus petits qu'un globule rouge) et arrivent à proximité des tumeurs
cancéreuses.
Il faut
savoir que dans ces zones se créent des vaisseaux sanguins qui vont déboucher sur les vaisseaux normaux
de l'organisme.
La
structure épithéliale de ces vaisseaux parasites est lâche, discontinue
(contrairement à celle des vaisseaux normaux qui est imperméable) c'est-à-dire
qu'elle présente des pores ; les liposomes furtifs s'y engouffrent et vont
rejoindre les zones tumorales.
Dans
ces zones, le pH est inférieur à 7 (caractère acide) ce qui entraîne une
déstructuration des liposomes et une libération du principe actif.
2-3) Liposomes
de 3ème génération
Le
mécanisme décrit pour les liposomes de deuxième génération n'est pas parfait ;
il arrive en effet que lors d'épisodes inflammatoires, la structure épithéliale
de certains vaisseaux sanguins normaux soit poreuse et permette le passage des
liposomes pégylés qui vont alors rejoindre des zones non tumorales ; ces zones
ont du fait de l'inflammation un pH diminué ; toutes les conditions sont
remplies pour que le principe actif soit libéré ; il peut alors agir sur des
cellules saines et les détruire.
On
modifie le système précédent qui est un système passif et on le transforme en
système actif ; c'est-à-dire qu'on modifie le liposome pégylé pour qu'une fois
arrivé dans la zone tumorale il se dirige vers les cellules cancéreuses, y
pénètre et déverse alors seulement le principe actif du médicament.
Le
principe est le suivant :
On fixe
à l'extrémité des chaînes de P.E.G. un ligand (par exemple l'acide folique) :

Muni de
ces molécules (on dit alors qu'il est décoré c'est le terme consacré), le
nanoliposome est capable de reconnaître de manière sélective des récepteurs à
la surface des cellules cibles. Dans le cas où on a fixé des molécules d'acide
folique comme ligand, les liposomes se fixent sélectivement sur les récepteurs
d'acide folique présents à la surface des cellules tumorales, celles-ci en
ayant beaucoup plus que les cellules saines.
Ils
pénètrent ensuite dans les cellules (phénomène d'endocytose) et libèrent le
principe actif qui va détruire ces cellules.

2-4) Les
principes actifs et les nanovecteurs :
2-4-1) Des vecteurs de principes actifs hydrophiles
:
Le mode
d'action des liposomes, qui vient d'être décrit, l'a été sur un principe actif
hydrophile qui se place donc dans la partie hydrophile du vecteur c'est-à-dire
au centre.
On peut
citer comme exemples de principe actif hydrophile :
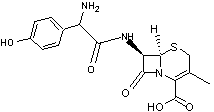
- La gentamycine, un antibiotique :
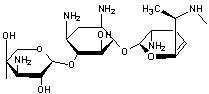
- Le céfradoxil, un autre
antibiotique :
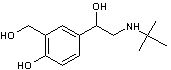
- Le salbutamol, un
bronchodilatateur utilisé pour des traitements anti-asthmatiques (Ventoline ®)
:
2-4-2) Des vecteurs
de principes actifs lipophiles :
Les
liposomes peuvent aussi servir à véhiculer des principes actifs lipophiles qui
se placent alors dans la couronne intérieure du liposome c'est-à-dire dans la
zone lipophile.

On peut citer comme exemples de
principe actif lipophile :
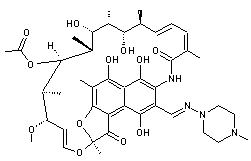
-
La rifampicine, un antibiotique à large spectre généralement utilisé pour
lutter contre la tuberculose et la méningite bactérienne :
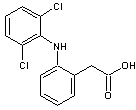
-
Le diclofénac, un anti-inflammatoire non stéroïdien (AINS) ; antalgique,
antipyrétique :
-
L'indométacine, un autre anti-inflammatoire non stéroïdien :
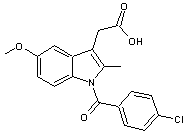
-
Le triméthoprime, un antibiotique à spectre large :
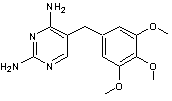
2-4-3)
Des vecteurs de principes actifs
amphiphiles :
Les
composés amphiphiles (à la fois hydrophiles et lipophiles) se distribuent dans
la bicouche lipidique et dans la phase aqueuse ; ils sont les plus difficiles à
encapsuler :

On peut citer comme exemples de
principe actif amphiphile :
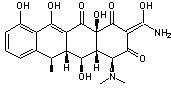
-
La doxorubicine :
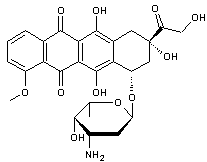
C'est une molécule de la famille des anthracyclines isolées à partir
d'actinobactéries du genre Streptomyces.
On l'a
utilisée dans les polychimiothérapies traitant les carcinomes du sein, les
sarcomes des os et des parties molles, les cancers du poumon et les leucémies
aigües et chroniques.
Dans les
chimiothérapies classiques son efficacité est restreinte par le fait qu'elle
possède une certaine cardiotoxicité qui en limite l'usage.
En
l'encapsulant dans des liposomes pégylés, on a augmenté son efficacité tout en
limitant sa toxicité.
-
La josamycine, un antibiotique à large spectre qui peut être obtenu par
fermentation de Streptomyces narbonensis :
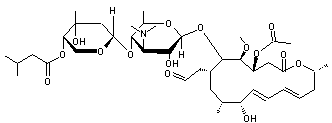
- La doxycycline, que l'on utilise
contre la syphilis, la peste, le choléra, la maladie du charbon, la maladie de
Lyme, mais aussi contre l'acné :
3)
Des polymères nanovecteurs :
De
nombreux polymères biodégradables sont utilisés en nanomédecine (voir annexe 2) :
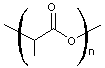
- PLA (le polylactide)
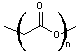
-
PLGA copolymère lactide glycolide
Poly(lactide-co-glycolide)
-
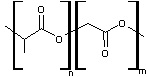
PACA (le polycyanoacrylate d'alkyle)
3-1) Nanovecteurs
polymères de première génération :
Comme dans
le cas des nanoliposomes, on encapsule le principe actif dans des
nanoparticules de PACA ou de PLA ; elles sont transportées jusqu'au foie ou la
rate, puis phagocytées par les macrophages qui constituent alors un réservoir
de principe actif ; libéré il joue alors son rôle de médicament.
3-2) Nanovecteurs
polymères de deuxième génération :
On rend
furtifs les nanovecteurs en fixant de manière covalente à la surface des
nanoparticules, des chaînes de PEG
exactement comme pour les liposomes.
C'est ainsi
que dans les années 1990 on a conçu le copolymère amphiphile, dibloc PLA-b-PEG
composé d'un bloc hydrophobe de PLA lié de manière covalente à un bloc
hydrophile de PEG.
On a ensuite
généralisé cette approche à d'autres polymères hydrophobes, PACA par exemple.
3-3) Nanovecteurs
polymères de troisième génération :
Comme dans
le cas des nanoliposomes, on fixe des ligands à l'extrémité des chaînes de PEG
et l'on obtient des systèmes actifs qui vont se fixer sur des récepteurs du
ligand correspondant présents à la surface des cellules cibles à détruire.
On a ainsi
construit des nanoparticules PLA-b-PEG pégylées ayant des ligands aux
extrémités des chaînes de PEG, qui peuvent être :
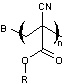
- de l'acide folique
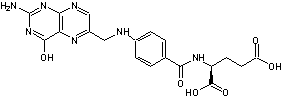
- de la biotine
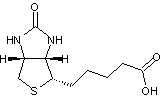
mais aussi
des peptides, de l'albumine, des lectines (protéines qui se lient
spécifiquement et de manière réversible à certains glucides ; elles
interviennent dans la reconnaissance entre les cellules), …
3-4) Nanovecteurs
polymères de quatrième génération :
Des
nanoparticules dites de quatrième génération ont été élaborées ; elles sont
faites pour répondre à des stimuli physiques externes comme un champ
magnétique, une variation de température, une application de lumière …
Comment
construire par exemple une nanoparticule sensible à l'application d'un champ
magnétique externe ?
On peut encapsuler au sein d'une
matrice polymère des nanocristaux magnétiques de magnétite (Fe3O4)
ou de maghémite (Fe2O3) :

Au moyen d'un aimant externe, on
peut alors guider ces nanoparticules au plus près de la tumeur.
Si l'on applique un champ magnétique
alternatif les nanoparticules peuvent générer de la chaleur dans le milieu
environnant (hyperthermie sélective des tumeurs à éliminer).
On peut aussi combiner les deux.
Remarque : Des essais de ce type ont
également été réalisés avec des nanoliposomes.
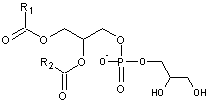
Annexe 1 Les phospholipides
1) Définitions
:
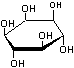
On
définira les glycérophospholipides qui sont de loin les constituants des liposomes
les plus nombreux.
Une
molécule de glycérol
![]()
peut
être estérifiée par un ou plusieurs acides gras sur ses trois fonctions alcool
; elle devient un lipide :
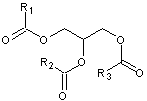
- Si elle est estérifiée par un ou
deux acides gras sur deux de ses fonctions alcool et par l'acide phosphorique
sur la troisième elle devient un acide phosphatidique :
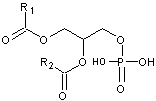
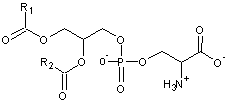
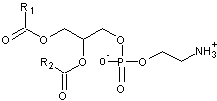
- Si un acide phosphatidique a une
deuxième fonction acide de l'acide phosphorique estérifiée par :
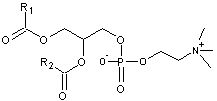
·
la choline :
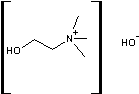
il
devient une phosphatidylcholine (abrégée en PC)
·
la sérine :
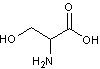
il
devient une phosphatidylsérine (abrégée en PS)
·
L'éthanolamine :
![]()
il
devient une phosphatidyléthanolamine (abrégée en PE)
·
l'inositol :
il
devient un phosphatidylinositol (abrégée en PI)
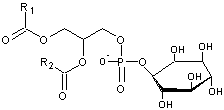
·
Le glycérol :
![]()
il devient un phosphatidylglycérol
(abrégée en PG)
Remarque :
Pour
tous les groupements phosphatidyl la dernière fonction acide de l'acide
phosphorique est ionisée (O-) car dans le milieu biologique dans
lequel il est plongé (sang) le pH se situe entre 7,35 et 7,45.
- Les groupements R1 et R2
correspondent aux chaînes des acides gras ayant estérifié deux des groupements
alcool du glycérol ; parmi les nombreux acides gras possibles on trouve les
acides :
Ø
Palmitique : un acide saturé en
C16 (abréviation P)
![]()
ou bien
Si les
deux fonctions alcool d'une phosphatidylcholine sont estérifiées par l'acide
palmitique on obtient
dont le
nom est DiPalmitoylPhosphatidylCholine ; son abréviation est DPPC.
Ø
Oléique : un acide
monoinsaturé en C18 : 1(9) (ou w-9) (abréviation O)
![]()
ou bien
Si les
deux fonctions alcool d'une phosphatidylcholine sont estérifiées par l'acide
oléïque on obtient
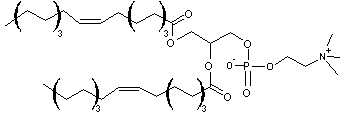
dont le
nom est DiOléylPhosphatidylCholine ; son abréviation est DOPC.
Ø
Si l'une des fonctions alcool est
estérifiée par l'acide palmitique et une autre par l'acide oléïque on obtient
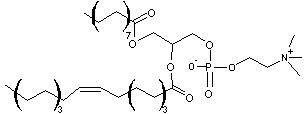
dont le
nom est 1-Palmitoyl-2-OléylPhosphatidylCholine ou POPC en abrégé.
Ø
Parmi les autres acides gras que l'on
rencontre couramment dans ces glycérophospholipides citons
L'acide stéarique
: un acide saturé en C18 (abréviation S)
![]()
L'acide laurique
: un acide saturé en C12 (abréviation L)
![]()
L'acide myristique
: un acide saturé en C14 (abréviation M)
![]()
2)
Charge globale des phospholipides :
Certains
phospholipides sont globalement électriquement neutres, à pH 7,4, c'est le cas
par exemple de DPPC ou de DPOC.
D'autres
sont globalement négatifs comme par exemple le cas du DPPS
(Dipalmitoylphosphatidylsérine) : charge -1
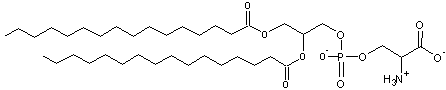
L'addition
de phospholipides chargés négativement (environ 15%) dans un phospholipide
neutre diminue l'agrégation des vésicules entre elles (répulsion
électrostatique) et permettent une captation plus grande des substances
hydrophiles.
On peut
ajouter à un phospholipide neutre de la stéarylamine (C18H39N)
en milieu aqueux
![]()
qui
apportera une charge positive et aura le même effet.
Quelques
phospholipides et leur charge permettant de fabriquer des liposomes :
|
Glycérophospholipides
neutres |
DMPC DPPC DOPC DOPE DPPE |
|
Glycérophospholipides
chargés négativement |
DPPG DMPG DPPA DPPS |

Mode
d'obtention de quelques polymères utilisés en nanomédecine :
- PLA (le polylactide)

Le monomère
est le lactide (ou 2,5-diméthyl-3,6-dioxo-1,4-dioxanne) :
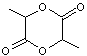
obtenu par
condensation de l'acide lactique
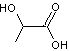
lui-même
obtenu par fermentation du D-glucose issu de l'amidon de maïs.
La
polymérisation du lactide a lieu par ouverture du cycle
(POC).
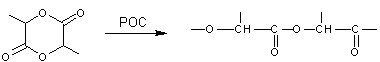
- PGA (le polyglycolide)
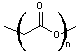
Le
monomère est le glycolide (ou p.dioxanne-2,5-dione) :
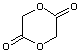
La
polymérisation a lieu par ouverture du cycle (POC),
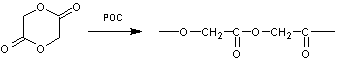
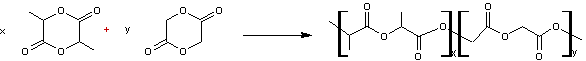
- PLGA copolymère lactide glycolide
Poly(lactide-co-glycolide)
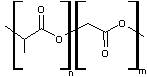
Le PLGA
peut résulter de la polycondensation d'acide lactique

et
d'acide glycolique
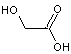
Par
estérifications successives, en proportions équimolaires et avec alternance
régulière on obtiendrait :
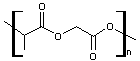
Mais la
synthèse se fait généralement par ouverture des cycles lactide

et
glycolide

On peut
écrire schématiquement :
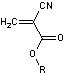
- PACA (le polycyanoacrylate
d'alkyle)

Le
monomère est le cyanoacrylate d'alkyle
La
polymérisation anionique est la suivante
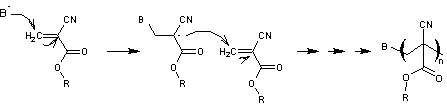
Le
polyéthylène glycol (PEG)
![]()
dont le
motif est
-CH2-CH2-O-