LES LIAISONS SIMPLES CARBONE-HALOGENE
Plan de la leçon:
1) Réactions
de substitution nucléophile
2) Réactions
d'élimination
1) Réactions de substitution nucléophile:
Les dérivés halogénés des alcanes
se prêtent bien à ce genre de réaction (attaque par un réactif nucléophile), du
fait de la polarisation de la liaison R-X due à la grande électronégativité de
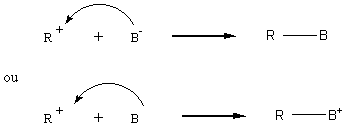
l'halogène![]() Le bilan d'une telle réaction est :
Le bilan d'une telle réaction est :
![]() :
:
ou
![]()
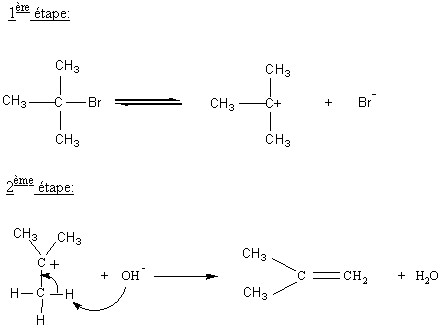
1-1) REACTION SN1 (Substitution Nucléophile monomoléculaire) :
1ère étape : c'est elle qui limitera la vitesse globale de la réaction, car c'est la plus lente des deux étapes :
![]()
Cette dissociation a généralement lieu sous l'effet d' un solvant protique, polaire et dissociant (un tel solvant possède un moment dipolaire important qui lui permettra en solvatant l'ensemble des particules du milieu de favoriser l'apparition de charges, et une forte constante diélectrique, qui influence l'énergie nécessaire à la séparation des deux charges de signe contraire; c'est le cas de l' eau, l' éthanol, le diméthylformamide); puis
2ème étape : plus rapide
exemple : action de OH- sur le 2-chloro-2-méthylpropane
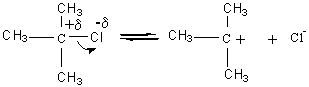
puis
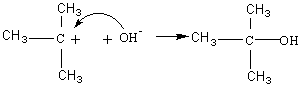
Le carbocation formé à la première étape est d'autant plus stable que le carbone correspondant est substitué.
Vitesse de réaction :
La vitesse de substitution selon ce mécanisme SN1 augmente donc dans le sens :
R3CX > R2CHX > RCH2X > CH3X
Le plus rapide Le moins rapide
Le facteur cinétique limitant étant la première étape, on a une loi des vitesses (pour les réactions SN1) de la forme : v = k [ R-X ] réaction d'ordre 1
Aspect stéréochimique
Le carbocation formé étant plan, l'attaque du réactif nucléophile peut avoir lieu des 2 côtés du plan; si le carbone est asymétrique, on aura formation des 2 énantiomères en quantité égale; on aura donc le racémique.
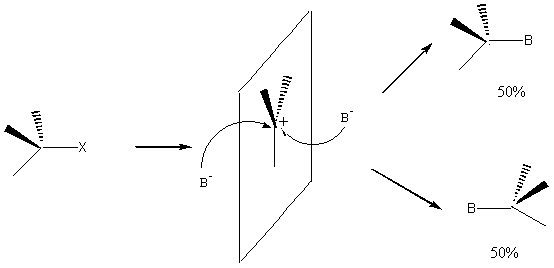
Remarque: Importance du solvant dans la stéréochimie du composé formé
La racémisation totale (50% de chaque
stéréoisomère) n'aura effectivement lieu que dans des conditions trés
particulières :
- le carbocation devra être suffisamment stable (sa solvatation y contribuera)
pour que l'ion X- ait le temps de s'éloigner de lui afin de ne pas gêner
l'approche de B- du côté où il se trouve ;
- ou bien la solvatation de cet ion X- devra être telle qu'elle
masque cet ion au réactif B-.
Ces deux conditions dépendent des propriétés du solvant utilisé pour cette réaction ; il faut un solvant qui stabilise à la fois cation et anion, l'eau est un tel solvant.
Si le solvant utilisé ne remplit pas ce rôle, on aura en majorité l'isomère résultant de l'inversion " en parapluie".
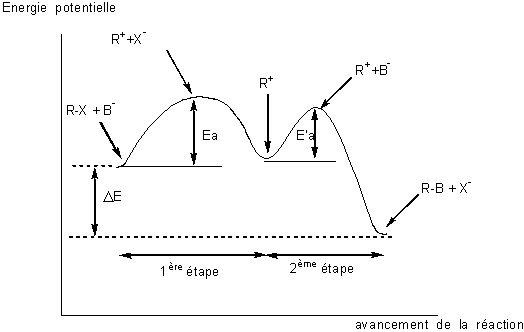
Aspect énergétique
D'un point de vue thermodynamique la réaction pourra avoir lieu spontanément
puisque la variation d'énergie potentielle entre produits et réactifs est
négative ( DE < 0); réaction
exoénergétique. D'un point de vue cinétique l'énergie d'activation, Ea, de la
première étape ( séparation de R-X avec formation du carbocation R+
) est supérieure à celle, E'a, de la seconde (formation de R-B) ; cela montre
que l'étape 1 est plus lente que l'étape 2 ; cette réaction à 2 étapes est dite
réaction complexe.
1-2) REACTION SN2 (substitution nucléophile bimoléculaire) :
une seule étape
: 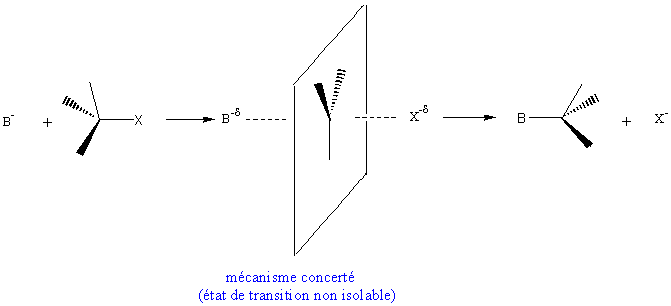
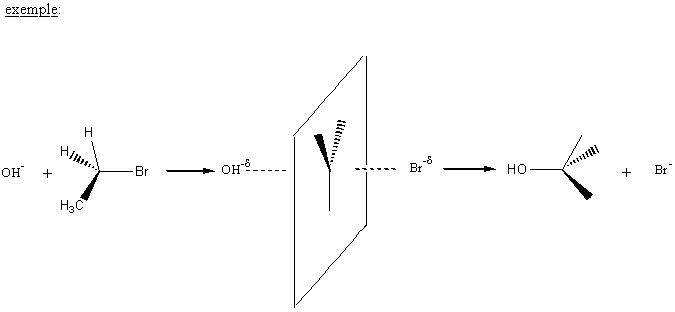
Remarque: dans ce mécanisme il y a dispersion de la charge totale qui reste constante; la polarité du solvant défavorisera un peu une telle réaction.
vitesse de réaction :
la vitesse est d'autant plus grande que le composé est moins substitué:
CH3X > RCH2X >R2CHX > R3CX
Le plus rapide Le moins rapide
v = k [ R-X ] [B-] réaction d'ordre global 2
Aspect stéréochimique
Si le carbone est asymétrique, la réaction conduit à une inversion de la configuration ( inversion de WALDEN).
Remarque: Cette inversion ne veut pas forcément dire qu'un composé R deviendra S et inversement ; un composé R peut rester R ou devenir S et un composé S peut rester S ou devenir R, cela dépendra de la nature du groupement substituant.
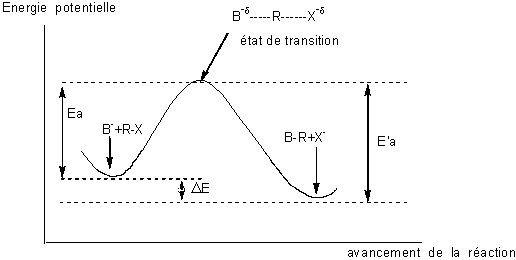
Aspect énergétique
D'un point de vue thermodynamique la réaction pourra avoir lieu spontanément puisque
la variation d'énergie potentielle entre produits et réactifs est négative ( DE < 0); réaction exoénergétique.
D'un point de vue cinétique on s'aperçoit que cette réaction a lieu en une
seule étape ; c'est une réaction élémentaire
1-3) REMARQUES
:
- Il est rare qu'une réaction se fasse uniquement selon l'un des deux mécanismes décrits ; souvent, elle se fera surtout suivant l'un des deux types (SN1 ou SN2) et un peu suivant l'autre. Pour augmenter l'importance de l'un et minimiser celle de l'autre, on se souviendra, que SN2 dépend beaucoup du pouvoir nucléophile du réactif, tandis que SN1 n'en dépend pas; on se souviendra aussi que la vitesse d'une réaction SN2 dépend beaucoup de la concentration en réactif SN1 n'en dépend pas.
- exemple l'hydrolyse de CH3-Cl sera de type SN2 si
l'on choisit un solvant peu polaire comme l'éther ou la propanone, alors
qu'elle sera de type SN1, si l'on choisit un solvant trés ionisant comme
l'acide méthanoïque ou le DMSO.
2)Les réactions d'élimination :
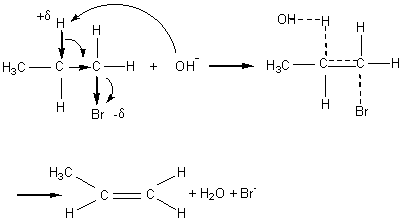
2-1) Bilan : Les dérivés halogénés donnent assez souvent aussi des réactions d'élimination; on les prendra comme exemple:
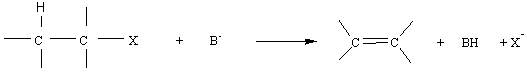
Il faut, on le voit, qu'il possède au moins un atome d'hydrogène sur un carbone adjacent à la liaison C-X. Cette réaction est une déshydrohalogénation, elle a lieu sous l'action d'une base.
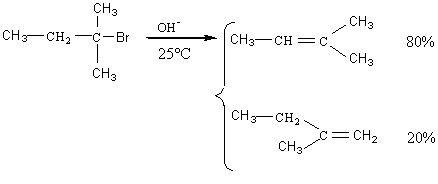
Remarque : réaction régiosélective : si la double liaison peut se former avec 2 carbones adjacents qui portent un H, elle se forme de préférence avec celui qui est le plus substitué (règle empirique de Zaïtsev).
Exemple :
2-2) Elimination monomoléculaire ou E1 :
1ère étape : la plus lente
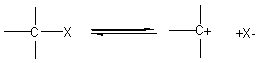
2ème étape : la plus rapide
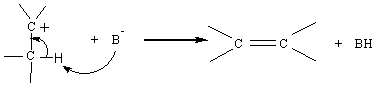
Vitesse de réaction :
v = k [R-X] ordre 1
Ces réactions ont lieu plus facilement avec des carbones (III) (carbocations plus stables), avec des bases faibles (ammoniac NH3, amines R-NH2, ou alcools R-OH), et des solvants protiques
Exemple :
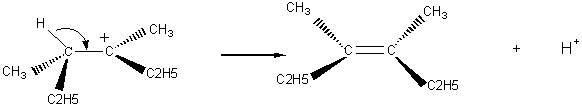
Stéréochimie :
si la molécule de départ le permet (voir ci-dessous) le mécanisme E1
conduit à un mélange de stéréoisomères Z et E
· Isomère Z
- Isomère E
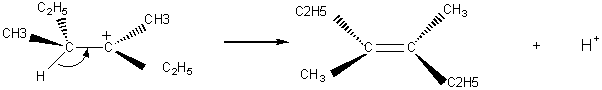
Remarque:
Le carbocation formé à la première étape, peut s'isomériser, parfois, pour
conduire à un carbocation plus stable ( par exemple un R+
secondaire -------> R+ tertiaire ). Il y aura alors
aussi,formation d'alcènes isomères des produits attendus.
2-3) Elimination bimoléculaire ou E2 :
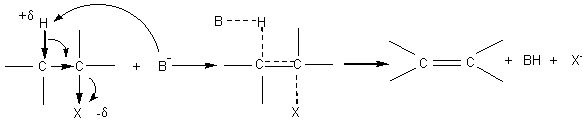
Exemple :
Vitesse :
v = k [RX] [B-]
Ces réactions ont lieu plus facilement avec des carbones (I), des bases fortes (OH-(soude potasse), RO- (alcoolates), NH2- (amidures)) des solvants aprotiques.
Stéréochimie :
C'est une anti-élimination (on dit parfois trans-élimination).
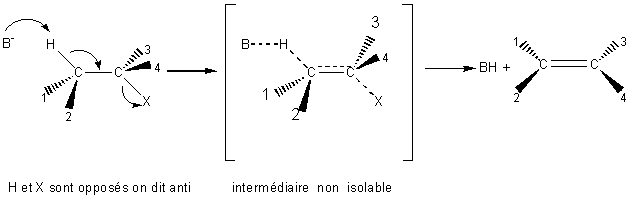
Remarque : Il s'agit donc d'une réaction stéréospécifique: si
les deux carbones sont asymétriques, on obtient un seul stéréoisomère Z ou E et
non un mélange comme dans le mécanisme E1.