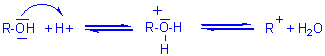LES LIAISONS SIMPLES CARBONE-OXYGENE
Plan de la leçon:
1) Réactivité
du groupement fonctionnel alcool
2) Formations
d'éthers-oxydes
3) Déshydratation
intramoléculaire d'un alcool en milieu acide
4) Compétition
entre Elimination et substitution nucléophile
5) Passage
de ROH à RX (alcool à halogénoalcane)
1) Réactivité du groupement fonctionnel alcool:
1-1) généralités:
Le groupe
fonctionnel alcool est caractérisé par deux propriétés de l'atome d'oxygène:
- sa forte électronégativité,
qui polarise les deux liaisons C-O et O-H :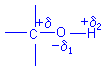
- la présence sur cet atome de deux doublets libres d'électrons :![]()
1-2)Conséquences :
- Ce sont des acides faibles; la liaison ![]() polarisée
par l'électronégativité de
polarisée
par l'électronégativité de
l'atome d' oxygène l'est cependant moins que dans l'eau, car l'effet inductif
de ![]() contrarie cette
contrarie cette
polarisation. On le constate bien lorsque l'on passe de ![]() à
à 
et  ; les alcools III sont beaucoup plus faibles que les
alcools II ou I.
; les alcools III sont beaucoup plus faibles que les
alcools II ou I.
CH3OH pKa =
15,5; CH3-CH2OH pKa = 15,9; ![]() pKa = 17,2;
pKa = 17,2;
- Les ions R-O- (alcoolates) sont au contraire des bases fortes;
l'action d'un acide protonique fort (HCl en solution par exemple) qui conduira
à ![]() (R+ hydraté) par fixation
d'un H+ sur le doublet libre de l'oxygène, sera facilité par
l'abondance des charges négatives sur O, donc par l'effet inductif des
groupements R.
(R+ hydraté) par fixation
d'un H+ sur le doublet libre de l'oxygène, sera facilité par
l'abondance des charges négatives sur O, donc par l'effet inductif des
groupements R.
Les bases qui correspondent aux alcools III
seront donc plus fortes que celles qui correspondent aux alcools II ou aux
alcools I.
1-3) La réactivité des alcools, dépend du milieu dans lequel a lieu la réaction.
- en milieu basique il y a rupture de la liaison O-H
RO- a des propriétés nucléophiles et basiques; il pourra provoquer des substitutions sur des molécules d' halogénoalcanes par exemple (synthèses de Williamson ), ou des éliminations.
- en milieu acide il y a rupture de la liaison C-O
Remarque: la protonation de
l'oxygène de l'alcool, transforme le "difficile" groupe sortant OH en
"bon" groupe sortant H2O.
2-1) Synthèse de Williamson:
En milieu basique on a tout d'abord : ![]() puis
puis
bilan: ![]()
mécanisme: R'O-, réactif nucléophile,
induira une substitution SN2, facile avec les iodures
moins avec les bromures et beaucoup moins avec les chlorures ( I-
plus mobile que Br- ou Cl- ).
La vitesse, sera plus grande, pour les halogénures I que pour les halogénures
II ou III .
remarque: Cette réaction ne peut fonctionner
correctement, avec ROH (l'alcool) car un alcool a
un pouvoir nucléophile trés faible et la réaction
![]()
est trés lente et limitée.
2-2) Par déshydratation intermoléculaire d'un alcool en milieu acide:
(formation d'un éther-oxyde symétrique)
Bilan : ![]()
Mécanisme 1 (avec H2SO4 acide protonique):
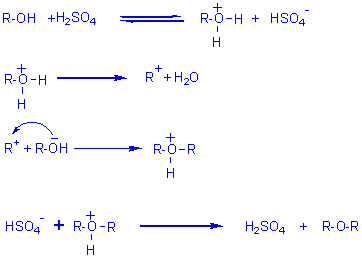
Remarque: ce mécanisme qui fait intervenir une substitution nucléophile
SN1 (formation
préalable d'un carbocation puis attaque par un nucléophile), aura surtout lieu
avec des
alcools II; avec des alcools I, on aura plutôt une substitution SN2 (car la
stabilité du
carbocation est moindre):
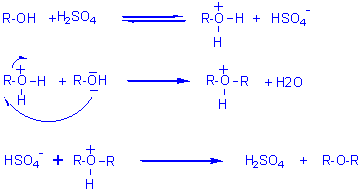
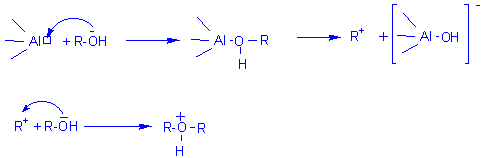
Mécanisme 2 (avec Al2O3 qui se comporte comme un acide de
Lewis):
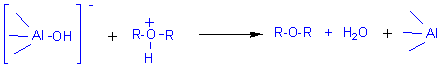
3) Déshydratation intramoléculaire d'un alcool en milieu acide :
Bilan: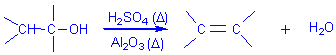
Mécanisme (avec H2SO4 acide protonique):

puis:
- avec un alcool I : Elimination E2
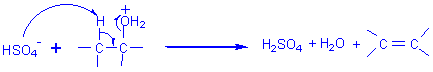
- avec un alcool II: Elimination E1
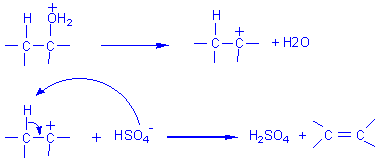
Remarque:
règle de Zaïtsev : C'est le carbone le moins hydrogéné qui cède
l'hydrogène;
c'est le but-2-ène (![]() ) et non
) et non
le but-1-ène(![]() ) qui se forme lors de la
) qui se forme lors de la
déshydratation du butan-2-ol (![]() )
)
4)Compétition entre Elimination et substitution nucléophile:
Prenons l'exemple de l'éthanol :
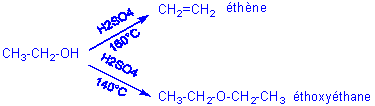
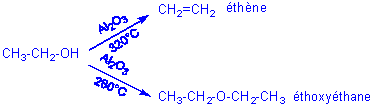
D'une façon plus générale, la plus haute température favorisera l'élimination et donc la formation d'une double liaison.
5) Passage de ROH à RX (d'un alcool à un halogénoalcane) :
5-1) par HX (avec X = Cl,Br,I):
Bilan :
![]()
réactions lentes et équilibrées à température ordinaire
Mécanisme :
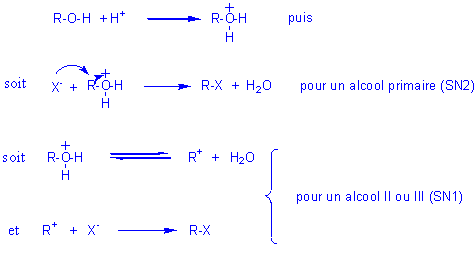
Remarques:
-1- afin de faciliter la formation de ![]() on ajoute au milieu de l'acide
on ajoute au milieu de l'acide
sulfurique H2SO4 .
-2- D'une façon générale, les alcools III réagissent plus
rapidement que les II ou les I;
-3- D'une façon générale la réaction est plus facile
avec HI qu'avec HBr ou HCl.
-4- On peut catalyser les réactions faites avec HCl, en les
réalisant en présence de
ZnCl2 dissous dans HCl concentré (réactif de Lucas);elles
deviennent alors,
à la température ordinaire, instantanées avec les alcools III, assez rapides
avec les alcools II, et en chauffant, moins lentes avec les alcools I.
On admet que l'ion Zn2+ se
comporte comme un acide de Lewis et en se fixant
sur un doublet libre de l'oxygène du O-H, facilite la rupture de la liaison C-O
comme le fait le H+ d'un acide protonique
: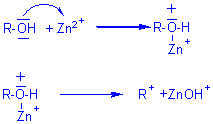
![]()
5-2) par PCl3, PBr3, SOCl2 :
- Action du tribromure de phosphore:
![]()
- Action du trichlorure de phosphore:
![]()
- Action du chlorure de thionyle :
![]()