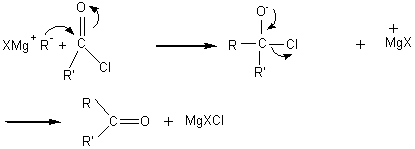LES
ORGANOMAGNESIENS MIXTES
Ou
réactifs de GRIGNARD
Plan de la leçon :
1) Généralités sur les organo-métalliques
2) Préparation des organomagnésiens
mixtes
3) Structure d'un organomagnésien
4) Réactivité des organomagnésiens
1) Généralités sur les organo-métalliques
:
Ce sont des composés dans lesquels un métal
(alcalin : Na,Li... ou
divalent Mg,Cd,Zn...) est
directement lié à un ou plusieurs carbones d'une molécule organique.
Leur importance en synthèse est considérable; parmi
eux, les organomagnésiens (découverts
par GRIGNARD prix Nobel en 1912) sont trés utilisés.
2)Préparation des organomagnésiens mixtes :
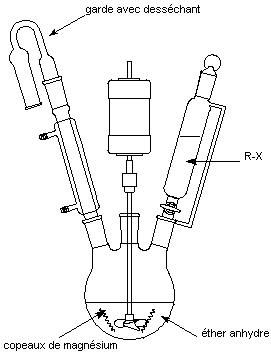
Action directe, à
froid, du magnésium non oxydé, en copeaux, sur un halogénure d'alkyle, d'aryle
(également, halogénoalcènes,
ou halogénoarènes) en présence d'éther (éthoxyéthane: C2H5-O-C2H5))
|
|
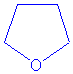
ou de THF(tétrahydrofuranne
nom commun de l' oxacyclopentane ).
|
|
L'équation bilan s'écrit :
![]()
(écriture symbolique de ce réactif ; voir
structure des organomagnésiens).
Les chloroalcanes sont moins réactifs que les bromo et que les iodoalcanes; les dérivés fluorés ne
sont pas utilisés).
Les iodoalcanes étant plus difficiles à préparer ce
sont les dérivés bromés qui sont les plus utilisés.
Le groupement R- peut-être un groupement alkyle, saturé ou non, ou aryle.
Remarque 1 : ils sont trés sensibles à
l'humidité et à l'oxygène et doivent donc être préparés et utilisés
à l'abri de l'air, dans des conditions rigoureusement anhydres, faute de quoi
il pourra se produire une
réaction secondaire (parfois trés violente):
![]()
Remarque 2 :Le magnésium doit être trés pur ; ses impuretés, en effet (Fe, Mn, Cu, Zn ......),
conduiront
à des réactions secondaires, comme celle de Würtz,
par exemple:
![]()
Remarque 3 :ils ne sont jamais isolés, mais préparés au moment où ils
vont être utilisés.
Remarque 4 :Les magnésiens
acétyléniques ne sont pas préparés directement, mais par action d'un
acétylénique vrai, sur un organomagnésien:
![]()
Remarque 5 :Les magnésiens alcényliques
et allyliques, par contre, se préparent directement:
exemples

:
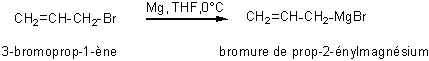
3) Structure d'un organomagnésien:
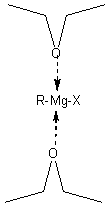
Il y a
coordination au magnésium, de deux molécules d'éther, les atomes d'oxygène
jouant le rôle
de donneur d'électrons (base de Lewis).
Les molécules d'éther font partie de l'organomagnésien mais souvent on ne les
fait pas apparaître.
Remarque :Notion d'acide et de base selon Lewis:
- Un acide est une entité, ayant un atome susceptible de se fixer sur un
doublet électronique libre;
Cette définition est plus générale que celle de Brönsted, et si H+ est un acide d'aprés cette définition,
il en est de même de BF3 , Zn2+ , AlCl3, R-Mg-X
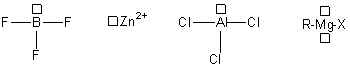
- Une base est une entité
possédant un doublet électronique libre.
Cette définition n'est pas trés éloignée de celle
de Brönsted ; ainsi HÖ- est une base, mais aussi
H-Ö-H, C2H5-Ö-C2H5
.....
Conséquence: la fixation des 2 molécules
d'éther sur l'organomagnésien est donc une réaction acido-basique
selon la terminologie de Lewis.
L' éther (éthoxyéthane) peut
être remplacé par d' autres bases de Lewis (autres éthers comme par exemple
un éther-oxyde interne le THF, mais
aussi amines  ou sulfures).
ou sulfures).
4) Réactivité des organomagnésiens
4-1) généralités:
La molécule est
polarisée selon:
![]()
eIlel subit, lors d'une réaction, une rupture
hétérolytique
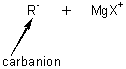
Ce carbanion a deux caractères, qui vont expliquer
les propriétés chimiques de ces composés:
- c'est une base trés forte ; elle va
donc réagir avec les composés à hydrogène mobile
(eau, alcools, phénols, thiols, amines I et II,
acides carboxyliques, alcynes vrais).
- c'est un nucléophile et réagira de ce fait, sur des carbones d+ (déficitaires en électrons).
Ces carbones étant, saturés, on aura donc des substitutions
ou non saturés, on aura alors
des additions .
4-2) Réactions liées à la basicité du carbanion:
bilan général de ces réactions
:
![]()
H-Y étant un composé à hydrogène mobile qui se comportera comme un acide vis à
vis du carbanion;
il peut être:
H-OH (eau), H-X (hydracide halogéné), H-OR alcool, H-OAr
(phénol), H-OOC-R
(acide carboxylique), H-NH2 ( ammoniac) ou H-NH-R (amine primaire),![]()
alcyne vrai.
Ce dernier cas étant le seul vraiment intéressant car il conduit à un
organomagnésien acétylénique:
![]()
4-3) Réactions
liées à la nucléophilie du carbanion:
- avec un composé saturé, il y a substitution:
- Dérivés halogénés :
![]()
- Orthoformiate
d'éthyle
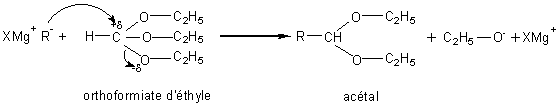
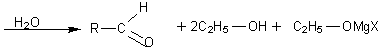
Il s'agit d'une
méthode intéressante de préparation des aldéhydes avec allongement de la
chaîne carbonée (on passe de R- à R-CHO).
- avec un composé non saturé, il y a addition :
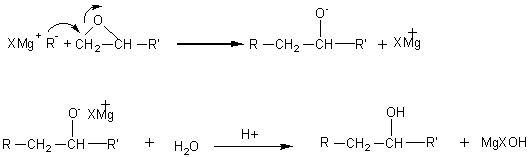
- Réactions sur le groupe carbonyle
bilan:
![]()
mécanisme:
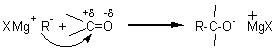 puis
puis
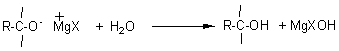
applications:
*aldéhydes
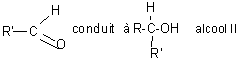
*cétones
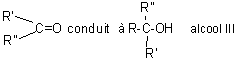
*esters
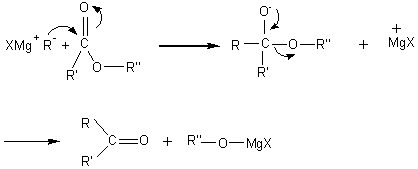
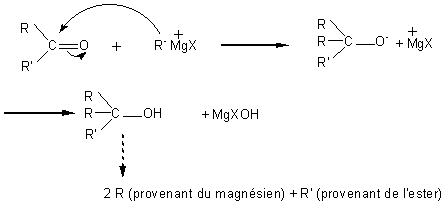
alcool III
*chlorures d'acyle
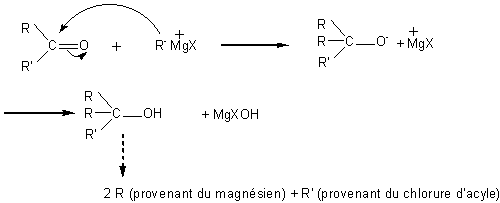
alcool III
*Dioxyde de carbone
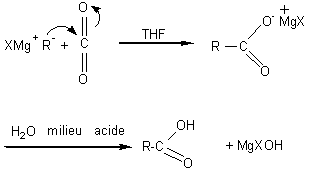
- Réactions sur les nitriles:
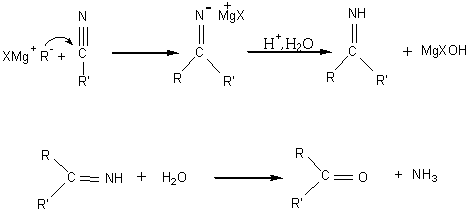
- Réactions sur les époxydes :