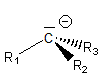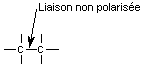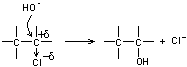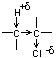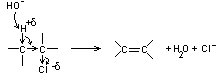MECANISMES REACTIONNELS
Introduction
Plan de la leçon:
1) Définition
2) Réactions homolytiques et réactions
hétérolytiques
3) Réactifs
nucléophiles - réactifs électrophiles
4) Solvants
protiques et non protiques ; polarité d'un solvant;
pouvoir
dissociant d'un solvant.
5) Les
intermédiaires réactionnels
6) Polarisation
et polarisabilité d'une liaison
7) Effet
inductif
8) Effet
mésomère
C'est une suite chronologique
d'étapes élémentaires qui conduisent des réactifs aux produits, contrairement à
l'équation bilan qui affiche seulement, les réactifs d'un côté, les produits de
l'autre.
Exemple: Polymérisation de l'éthylène
bilan :
![]()
mécanisme :
Initiation
![]()
Propagation
![]()
Arrêt
![]()
2) Réactions homolytiques - Réactions
hétérolytiques
- réaction homolytique (ou radicalaire)
![]()
Rupture symétrique de la liaison covalente (formation de radicaux libres).
Cette rupture est en général initiée par des radiations U.V.
- réaction hétérolytique
Rupture dissymétrique de la liaison covalente
![]()
3) Réactifs nucléophiles - Réactifs électrophiles (dans les réactions hétérolytiques)
3-1) Réactif et substrat
Deux entités qui existent au début de la réaction
et qui réagissent l'une sur l'autre sont, si l'on s'en tient à l'équation
bilan, deux réactifs.
D'un point de vue "mécanisme", on distinguera, l'entité principale, celle dont on suivra
l'évolution, le devenir et que l'on qualifiera de substrat et l'entité qui agira sur le substrat et que
l'on appellera réactif.
C'est par rapport à la nature du réactif
(nucléophile ou électrophile) que l'on qualifiera la réaction de nucléophile ou électrophile.
3-2) Réactifs nucléophiles
Ils pourront être :
- des molécules :
![]()
On les désignera alors par B I
- des ions :
OH-,
RO-, CN-
On les désignera alors par B-
Leur propriété est d'attaquer des carbones déficitaires en électrons :
* des carbocations (voir plus loin) ;
* des molécules polarisées ayant un
carbone +d.
3-3) Réactifs électrophiles
- des ions:
NO2+,
Ar-N2+,….
On les désignera alors par A+
- des molécules polarisées (ou des molécules polarisables) :
![]()
On les désignera par ![]()
Leur propriété est d'attaquer des zones riches en électrons (doubles liaisons,
noyaux aromatiques).
3-4) Basicité et nucléophilie
- La basicité (selon la définition de Brönstedt) est l'aptitude d'une molécule ou d'un ion à accepter un proton.
- La nucléophilie est l'aptitude d'une molécule ou d'un ion à attaquer des carbones déficitaires en électrons.
Ces deux propriétés semblent en étroite corrélation et sont pourtant trés dissemblables:
- La basicité est un phénomène thermodynamique, il s'agit d'un équilibre entre une base et son acide conjugué;
- La nucléophilie est un phénomène cinétique, elle est liée à la vitesse de réaction d'un nucléophile avec un électrophile.
Remarque: La nucléophilie est gênée par la solvatation par des solvants protiques (voir la définition de ces solvants plus loin) ; Pour une même charge électrique négative portée, un ion sera d'autant plus nucléophile qu'il sera volumineux.
Par exemple F- sera trés solvaté par un solvant protique car sa charge est concentrée.
Au contraire I- sera entouré de moins de
molécules du même solvant car sa charge (pourtant identique à celle de F-)
sera beaucoup plus répartie, diffuse.
En conséquence, les molécules de solvant constitueront pour F- une
barrière (une enveloppe) qui l'empêchera de réaliser une attaque nucléophile et
ceci de façon beaucoup plus marquée que pour I-.
4) Solvants protiques et aprotiques ; polarité d'un solvant ; pouvoir dissociant d'un solvant
- Les solvants capables de donner des liaisons hydrogène parce qu'ils contiennent un H polarisé + sont qualifiés de solvants protiques (R-COOH, R-OH, H2O,...).
- Les solvants qui ne contiennent pas d'H polarisés positivement sont aprotiques (propanone, diméthylsulfoxyde (DMSO), diméthylformamide (DMF)....).
- Un solvant ayant un moment dipolaire, facilite l'ionisation des molécules qui sont dissoutes (action chimique) ; on dira qu'il est polaire.
- Un solvant ayant une forte constante diélectrique facilite la séparation des ions, on dit qu'il possède un fort pouvoir dissociant.
Remarque 1 : Polarité de quelques solvants
Peu polaires : benzène (C6H6), cyclohexane (C6H12), sulfure de carbone (CS2), tétrachlorométhane (CCl4).
Moyennement polaires : éther (C2H5-O-C2H5), éthanol absolu (C2H5-OH), acide éthanoïque (CH3-COOH), propanone (CH3-CO-CH3), chloroforme (CHCl3), pyridine (C5H5N).
Fortement polaires : eau, acide méthanoïque (H-COOH), méthanol (CH3-OH), DMSO (diméthylsulfoxyde), diméthylformamide.
Remarque 2 :comme on le voit
dans les exemples ci-dessus, il existe des solvants polaires protiques (eau,
H-COOH), et des solvants polaires non protiques (DMSO par exemple).
5) Les intermédiaires réactionnels :
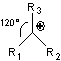
5-1) Les radicaux libres
|
|
* Un carbone porte un électron célibataire *Structure plane en général |
* Stabilité
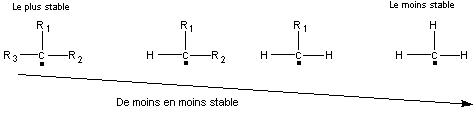
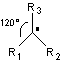
5-2) Les carbocations
|
|
* Un carbone a perdu un de ses électrons * Structure plane |
* Stabilité
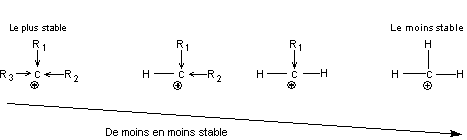
-> représente l'effet inducteur de R (radical alkyle, donneur d'électrons).
5-3) Les carbanions
|
|
* Un carbone a gagné un électron * Structure pyramidale * Stabilité : Ils sont très instables et ne peuvent être isolés |
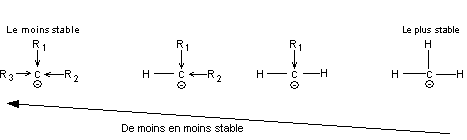
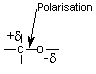
6) Polarisation et polarisabilité d'une liaison
|
|
Répartition électronique symétrique entre les deux atomes de carbone. |
|
|
Répartition électronique dissymétrique (en permanence) entre C et O car O est plus électronégatif que C. |
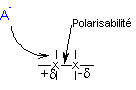
|
|
L'approche d'un réactif peut modifier momentanément la répartition électronique entre deux atomes identiques. |
7) Effet inductif (ou
inducteur)
se traduit par une dissymétrie de la répartition électronique de la liaison
covalente s entre
2 atomes, sous l'effet :
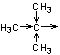
- de groupes donneurs d'électrons (effet
inducteur répulsif) :
· groupes alkyles
|
|
|
- métaux.
- de groupes attracteurs d'électrons (effet inducteur attractif)
- F, Cl, Br, I (halogènes: plus électronégatifs que le carbone), OH, NH2, CN, OCH3
![]()
L'effet inductif favorise parfois l'action de réactifs qui
sont riches en électrons (ils attaquent les sites déficitaires d+) ou pauvres en électrons (ils
réagiront sur des sites riches en électrons d-).
Exemple : action d'une base sur un dérivé halogéné pour donner un alcool
par substitution
|
|
|
Dérivé halogéné |
|
|
Remarque : l'effet inductif peut se propager au travers des liaisons covalentes voisines, mais en s'affaiblissant :
|
|
et l'action d'une base sur un dérivé halogéné peut de ce fait aussi conduire à une réaction d'élimination.
|
|
C'est une délocalisation électronique
dans certaines molécules à double ou triple liaison ou à structure aromatique
- 1er exemple : Le benzène

On ne peut représenter convenablement par une seule formule de Lewis, la structure du noyau benzénique (les 6 électrons sont délocalisés sur les 6 atomes de carbone du cycle). On utilise donc plusieurs formules qui sont dîtes mésomères ; aucune de ces deux formule ne traduit la structure réelle de la molécule; celle-ci est un hybride entre ces formes limites ; on dit aussi qu'il y a résonance entre ces formes limites.
- 2ème exemple : Le chlorure de vinyle
![]()
Voici 2 formes limites mésomères de la molécule de chlorure de vinyle ; la forme 1 a un poids beaucoup plus important que la forme 2, ce qui explique que bien que la structure réelle soit intermédiaire entre ces deux formes, elle est plus proche de 1 et c'est cette forme que l'on adopte pour la représentation du chlorure de vinyle.
On pourrait représenter ainsi la molécule :
![]()
Il s'agit
d'un effet
mésomère donneur du chlore.
- 3ème exemple : Aldéhyde benzoïque
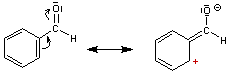
Il s'agit d'un effet
mésomère accepteur de l'oxygène.
- 4ème exemple :buta-1,3-diène
![]()
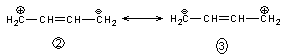
Les formes 2 et 3 ont un "poids" faible comparé à la forme 1. On peut être tenté aussi de représenter la réalité par
![]()
On dit que les doubles liaisons sont conjuguées.
Remarque : ces formes
mésomères expliquent pourquoi l'action de HCl sur le buta-1,3- diène, conduit à
80% de
![]()
mais aussi 20% de
![]()
résultat des formes 2 et 3.
La
structure réelle est toujours plus stable que les formes limites qui la
représentent.