ACIDES AMINES
Propriétés chimiques générales
Les acides aminés possèdent deux groupes fonctionnels
différents : le groupe acide carboxylique -COOH et le groupe amine -NH2
. Leur rôle biochimique est considérable.
Les acides a -aminés ou a -amino acides sont des composés qui
possèdent les deux groupes fonctionnels greffés sur le même atome de carbone. Les vingt acides aminés naturels les plus courants
constituent les éléments de construction des protéines et ce sont tous des
acides a -aminés.
1) Généralités
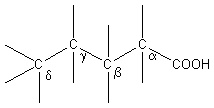
1-1) Elément de
nomenclature. Positions repérées par a ,
b , g etc..
Le groupe
fonctionnel d’un acide carboxylique est toujours en bout de chaîne. L’atome de
carbone qui lui est directement lié est appelé carbone en a du COOH ; les carbones suivants sont
respectivement en b, g, etc.
1-2) Chiralité
des molécules.
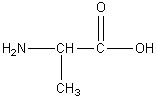
La formule
générale des acides a -aminés montre
que le carbone en a du groupe –COOH
porte quatre substituants différents (sauf pour la glycine) : c’est donc un
atome de carbone asymétrique.
Exemple : alanine ou acide amino 2-
propanoïque :
Les molécules d’acides a -aminés autres que la glycine sont donc chirales. A chaque acide a -aminé n' ayant qu'un seul carbone asymétrique, correspond en fait deux molécules énantiomères : elles sont images l’une de l’autre dans un miroir plan et ne sont pas superposables.
2) Comportement des acides a -aminés en solution aqueuse.
2-1)Etude des équilibres
acido-basiques.
La présence
dans la même molécule de deux groupements fonctionnels antagonistes, l’un acide
: -COOH, l’autre basique : -NH2 , donne des propriétés
très particulières aux acides a
-aminés.
- En milieu très acide :
Le groupe acide –COOH n’est pratiquement pas ionisé :
R-COOH + H2O =
R-COO- + H3O+
Cet équilibre est presque totalement déplacé vers la gauche en présence
d’ions H3O+
Par contre
le groupe amine -NH2 est presque entièrement protoné :
R’-NH2 + H3O+ = R’-NH3+ + H2O
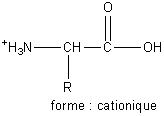
En milieu
très acide, l’acide aminé

existe essentiellement sous forme de cation :
- En milieu très basique :
Le groupe amine -NH2 n’est pratiquement pas ionisé.
Le groupe
acide –COOH perd son proton par réaction pratiquement totale avec les
ions hydroxydes HO- :
R-COOH + HO-
= R-COO- + H2O
En milieu très basique, l’acide aminé existe essentiellement sous forme de l’anion :
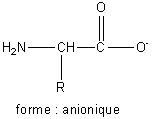
Les deux groupes fonctionnels antagonistes échangent un proton, Le groupe acide –COOH cède son proton tandis que le groupe amine -NH2 le capte. Il s’agit donc d’une réaction acido-basique intramoléculaire. Dans le milieu il existe alors un équilibre entre la forme moléculaire de l’acide aminé et une forme doublement ionisée globalement neutre que l’on appelle amphion ou encore zwitterion :
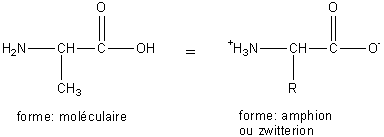
Remarques :
1- Cette
double ionisation permet d’expliquer la grande solubilité des acides aminés
dans l’eau, l’équilibre étant très déplacé vers la droite. En solution aqueuse
ils existent sous la forme d’ions dipolaires ammonium-carboxylate
2- Pour
faciliter l'écriture l'ion dipolaire est noté AH+ - .
3-
Inversement la solubilité dans les solvants organiques est faible.
4-
Equilibres acido-basiques : en solution aqueuse les acides a -aminés dont la chaîne latérale n’est pas
ionisable (dits acides aminés neutres) se comportent comme des ampholytes.
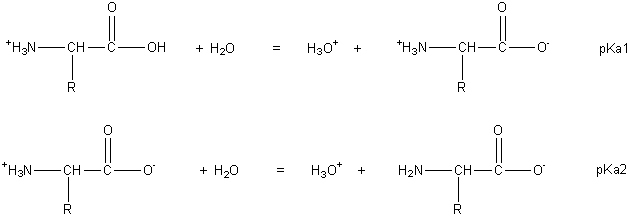
Ces deux équilibres peuvent être présentés sous les formes :
H2A+/HA+ - et
HA+ -/A-.
- Point isoélectrique :
Le passage d’un milieu très acide à un milieu très basique par augmentation
progressive du pH provoque le passage de la forme cationique à la forme
d’amphion puis à la forme anionique.
Il existe
donc, pour chaque acide a -aminé, une
valeur du pH pour laquelle l’amphion est majoritaire donc sa concentration
maximale. Ce pH particulier, compris entre pKa1 et pKa2,
est appelé point isoélectrique ; il se note pHi. Il est
caractéristique de chaque acide a
-aminé et sa valeur est donnée par la relation :
![]()
2-2) Applications.
2-2-1)Dosage
d’un acide a -aminé.
Le pH initial de la solution d'acide a-aminé
(à chaîne latérale neutre) permet de déterminer sous quelle forme se trouve
cette espèce. A partir de cela on peut réaliser le dosage par une base forte ou
un acide fort.
Les courbes obtenues lors des dosages pH-métriques d’acides a -aminés par une solution de base forte
(soude par exemple) montrent que seule la première acidité relativement forte
donne un saut de pH exploitable pour la détermination de la concentration.
2-2-2)L’électrophorèse.
L’électrophorèse est une méthode qui permet :
- de séparer différents acides a -aminés ;
- de purifier des acides a -aminés.
Ces deux opérations sont basées
sur leur migration différenciée sous l’action d’un champ électrique, à pH
contrôlé.
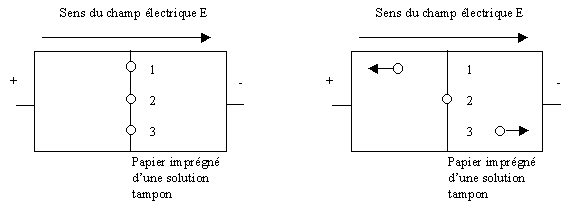
Trois acides aminés sont déposés en 1, 2 et 3 sur une même ligne centrale avant
l’établissement du champ électrique.
A une valeur
de pH bien déterminée, donnée par une solution tampon, correspondant au point
isoélectrique de l’acide a-aminé 2, en
présence du champ électrique, les acides a-aminés
migrent dans un sens ou dans l’autre, selon le signe de leur charge électrique.
Seul l'acide aminé 2 ne migre pas car il est à son pHi et donc pratiquement uniquement sous
forme d'amphion doublement ionisé.