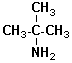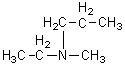AMINES ALIPHATIQUES
- Formule générale
- Nomenclature
- Structure
- Propriétés physiques
- Propriétés chimiques
- Préparations
- Résumé :
R-NH2 Amine
I (primaire)
R-NH-R'
Amine II (secondaire)
![]() Amine III (tertiaire)
Amine III (tertiaire)
- Amine primaire : On forme le nom à l'aide d'un préfixe qui est le nom de l'alcane (sans le "e" final) correspondant à la chaîne carbonée, suivi de l'indice de position du groupe amine sur cette chaîne et on termine par "amine".
Exemples :
|
Formule |
Nom |
|
CH3NH2 |
méthanamine |
|
CH3-CH2NH2 |
éthanamine |
|
CH3-CH2-CH2NH2 |
propanamine |
|
|
propan-2-amine |
|
|
2-méthylpropan-2-amine |
|
C6H5-CH2NH2 |
phénylméthanamine |
Remarque 1 :
On peut aussi ajouter le
suffixe amine au nom du groupe alkyle qui lui est lié : CH3-CH2-NH2 éthylamine
Remarque 2 :
S'il y a plusieurs
groupes fonctionnels amine : NH2-(CH2)4-NH2
butane-1,4-diamine
- Amines
secondaires :
On forme le nom à partir
du nom de l'amine primaire correspondant au groupe carboné ayant le plus
d'atomes de carbone que l'on fait précéder par la lettre "N" suivie
d'un tiret et du nom de l'autre groupe carboné lié à l'atome d'azote.
![]() N-méthyléthanamine
(Amine II)
N-méthyléthanamine
(Amine II)
- Amines
tertiaires :
On forme le nom à partir
du nom de l'amine primaire correspondant au groupe carboné ayant le plus
d'atomes de carbone que l'on fait précéder par la lettre "N" suivie
d'un tiret et du nom d'un des deux autres groupes carbonés liés à l'atome
d'azote, suivi d'une virgule et à nouveau de la lettre "N" suivie
d'un tiret et du nom du deuxième groupe carboné lié à l'atome d'azote (dans le
cas de groupes identiques on écrit deux lettres "N" séparées par une
virgule puis un tiret et on utilise le préfixe "di" suivi du nom du
groupe).
|
|
N-éthyl,N-méthylpropanamine |
|
|
N,N-diméthyléthanamine |
3) Structure - Isomérie :
3-1)Structure :
Dérivée de celle de
l'ammoniac:c'est une structure pyramidale.
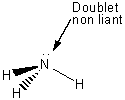 Ammoniac
Ammoniac
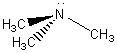 N,N-diméthylméthanamine
N,N-diméthylméthanamine
3-2) Isomérie :
Elle
peut provenir de la structure de la chaîne carbonée (constitution de la
chaîne), ou de la classe de l'amine (fonction) :
Exemple : C3H9N
Isomérie
de constitution :
CH3-CH2-CH2-NH2
propanamine
![]() propan-2-amine
propan-2-amine
Les
deux molécules sont des amines primaires.
Isomérie
de fonction :
![]() N-méthyléthanamine
N-méthyléthanamine
![]() N,N-diméthylméthanamine
N,N-diméthylméthanamine
Les
deux amines n'ont pas la même classe, l'une est secondaire et l'autre est
tertiaire.
4) Propriétés physiques:
A part les 3 amines:
![]() N,N-diméthylméthanamine
N,N-diméthylméthanamine
CH3-NH-CH3
N-méthylméthanamine
CH3-NH2
Méthanamine
qui
sont des gaz à température ambiante, les autres sont des liquides.
Dans
les amines liquides, il y a des liaisons hydrogène entre les molécules mais
moins fortes que dans les alcools :
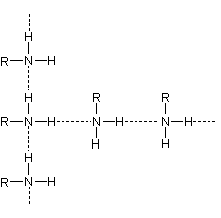
Ce
sont des solvants moins dissociants que l'ammoniac ; elles ont des odeurs
souvent très désagréables ; elles sont toxiques.
C'est essentiellement le doublet d'électrons de l'atome d'azote qui oriente ces propriétés (basicité et nucléophilie).
5-1) Combustion:
Le caractère organique des amines se révèle par la combustion (en comparaison,
l'ammoniac ne brûle pas) :
4 CH3NH2
+ 9 O2
---------> 4 CO2
+ 10H2O + 2N2
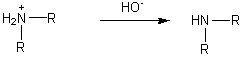
5-2) Caractère basique des solutions aqueuses :
La
fixation d'un ion H+ sur le doublet non liant de l'azote se fait
assez facilement ; ce sont des bases plus fortes que l'ammoniac, mais elles
restent des bases faibles.
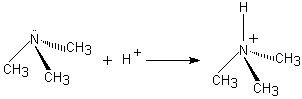
|
Amine |
(C2H5)2NH |
(CH3)2NH |
C2H5NH2 |
CH3NH2 |
(C2H5)3N |
(CH3)3N |
NH3 |
|
pKa |
11,1 |
10,8 |
10,7 |
10,6 |
10,6 |
9,8 |
9,2 |
---------------------------------> de plus en plus faibles--------------------------->
Remarque:La
basicité est croissante en passant de l'ammoniac aux amines primaires et
secondaires. On peut alors penser que les amines tertiaires sont les plus
basiques. Ce n'est pas le cas, leur pKa les place entre l'ammoniac et les
amines primaires. Ce phénomène est dû à l'encombrement stérique des groupes R
liés à l'azote ; ils empêchent les ions H+ d'approcher du doublet
d'électrons libres de l'azote ce qui diminue la basicité de ces amines.
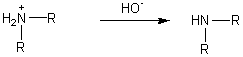
5-2-1) Les solutions aqueuses :
![]()
5-2-2) Action d'un acide :
![]()
5-2-3) Action
sur les ions métalliques :
- Ions Fe2+: En versant une solution aqueuse d'amine dans un tube
contenant des ions Fer(II) on observe un précipité vert d'hydroxyde de Fer(II)
: Fe(OH)2 insoluble dans un excès de solution d'amine.
- Ions Fe3+ : En versant une solution aqueuse d'amine dans un tube
contenant des ions Fer(III) on observe un précipité rouille d'hydroxyde de
Fer(III) : Fe(OH)3 insoluble dans un excès de solution d'amine.
- Ions Cu2+: En versant une solution aqueuse d'amine dans un tube
contenant des ions Cuivre(II) on observe un précipité bleu d'hydroxyde de
Cuivre(II) : Cu(OH)2 soluble dans un excès de solution d'amine ; on
obtient une solution bleue intense; il y a alors formation d'un ion complexe
[Cu(R-NH2)4]2+ ion tétrammine cuivre(II) dont
l'hydroxyde est soluble dans l'eau. Ce comportement est identique à ce qui se
passe avec une solution d'ammoniac.
5-3) Caractère
nucléophile des amines :
Le
doublet d'électrons des amines agit aussi sur les atomes de carbone polarisés
positivement des halogénoalcanes (R+d-X-d) ou des
alcools (R+d-OH-d).
5-3-1) Réaction
d'hofmann :
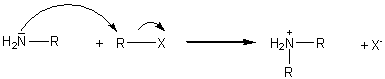
5-3-2) Réaction de Sabatier
:
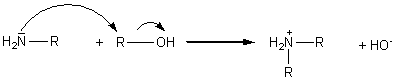
5-4) Propriétés
communes aux amines primaires et secondaires dues à la mobilité du H de N-H
:
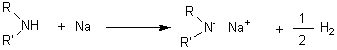
5-4-1) Action du sodium :
![]()
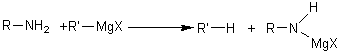
5-4-2) Action des organomagnésiens :
5-4-3) Réaction avec un acide carboxylique :
Elle
a lieu en deux temps :
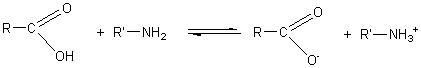
On
obtient un carboxylate d'ammonium substitué.
Un
léger chauffage conduit à la déshydratation de ce composé,

et
à la formation d'un amide substitué.
5-4-4) Action des chlorures d'acyles,des anhydrides d'acides, des esters
:
il
se produit une acylation c'est à dire la fixation du groupe acyle R-CO sur
l'amine pour donner un amide substitué.
Avec
un chlorure d'acyle par exemple :

5-5) Action
de HNO2 (acide nitreux) :
Rappel:
HNO2 est préparé in situ car il est instable : Na+ NO2-
+ H+ Cl- ------> HNO2 + Na+
+ Cl-
Amines primaires :

Amines secondaires : elles donnent des
nitrosamines
![]()
Amines tertiaires :
elles donnent des sels d'ammonium quaternaires
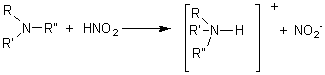
5-6) Formation
de carbylamines : en milieu non aqueux,à chaud, par réaction du chloroforme
et d'une
base
alcaline, les amines(I) donnent des carbylamines qui sont des composés à odeur
repoussante
même
à l'état de traces.
![]()
A l'état naturel, les amines
aliphatiques sont rares (on trouve par exemple la triméthylamine N(CH3)3
dans la décomposition des viandes).
Deux
types principaux de préparations :
6-1) alkylation de l'ammoniac NH3 (méthodes
d'Hofmann, de Sabatier, de Gabriel )
Méthode d'Hofmann :
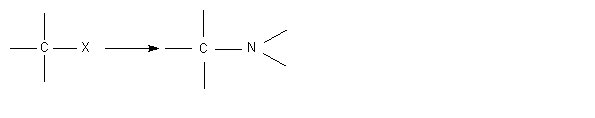

En
fait la réaction ne s'arrête pas là, l'ammoniac agit aussi sur le sel RNH3+ X-
pour donner R-NH2 qui réagit sur le dérivé halogéné en excès et ainsi de suite, et
l'on obtient un mélange d'ammoniac, d'amine primaire, secondaire et
tertiaire.
Méthode de Sabatier :
C'est l'action d'un alcool sur
l'ammoniac vers 300°C en présence de thorine (ThO2). Comme
avec la méthode d'Hofmann on obtient un mélange d'amines.
Méthode de Gabriel :
Pour
éviter ce mélange, Gabriel a mis au point une méthode, permettant de préparer
des amines primaires, seules.
Cette
synthèse tient en 3 étapes :
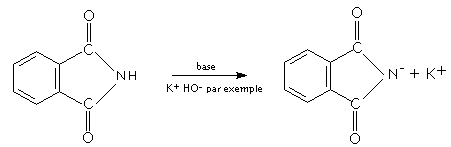
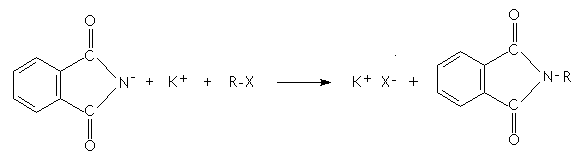
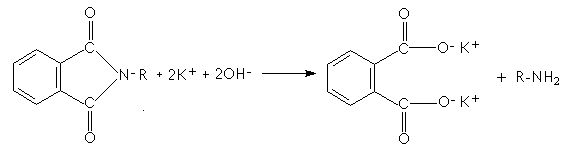
La molécule clé de cette synthèse est le phtalimide (amide
secondaire de l'acide orthophtalique) obtenu par action de l'ammoniac sur
l'anhydride orthophtalique :
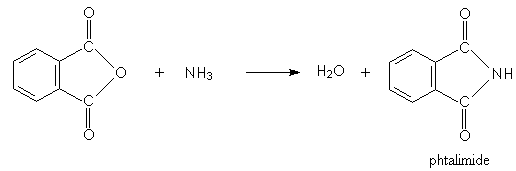
elle
permet de bloquer deux des trois hydrogènes de l'ammoniac.
6-2) A
partir des aldéhydes :
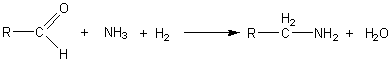
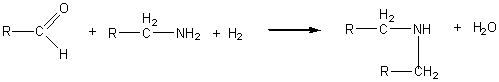
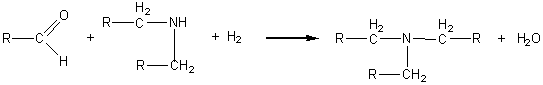
Remarque:en
dehors de ces méthodes, il existe des préparations par modification de la
chaîne azotée :
6-3) Réduction de
dérivés azotés :
surtout
par hydrogénation des nitriles
![]()
6-4) Dégradation des amides (d'Hofmann) :
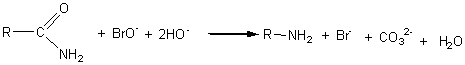
La
molécule a perdu 1 atome de carbone.