Blaue Flecken
Wolfgang Werner,
Münster
Der Blutfarbstoff wird in seiner Struktur und seiner Funktion
vorgestellt. Ebenso wird sein Abbau verfolgt. Ähnliche in der Natur vorkommende
Komplexe sind eingeschlossen. Fachausdrücke und Eigennamen werden durch Angaben
zu ihrer Etymologie verständlich
gemacht.
Blut
„Blut ist ein
besonderer Saft“ lässt Goethe Mephisto in Faust I sagen.
Zu Blut haben wir ein emotionales Verhältnis, das sehr
verschieden sein kann. Der wissenschaftliche Blick ist ebenfalls sehr
vielfältig und wird in der Hämatologie (griech.haima, Blut; logos, Lehre)
zusammengefasst. Blut ist eine Suspension von roten Blutkörperchen =
Erythrocyten (griech. erythros, rot; cytos, hohl und Zelle), weißen
Blutkörperchen = Leucocyten (griech leukos, weiß) und Blutplättchen im
Blutplasma. s.Tab.1.
Die zellulären Bestandteile , d.i. der Hämatokrit
(Abkürzung : hct) (griech. krites, Richter,) machen bei Männern 43 -50%, und
bei Frauen 35-44% des Blutes aus (hauptsächlich Erythrocyten). Dieser Wert gibt
auch einen Hinweis auf die Zähigkeit des Blutes. Das Blutplasma, das etwa einen
Anteil von etwa 50% des Blutvolumens ausmacht, ist eine leicht gelbliche
wässrige Lösung von kolloid gelösten Eiweißstoffen und von Elektrolyten. Die
Elektrolyten stehen in einem ähnlichem Verhältnis zueinander wie im Meerwasser.
Die Blutmenge eines Erwachsenen beträgt 5 bis 6 Liter.
Das Blut wird vom Herzen im Kreis gepumpt und gesaugt; es
ist das Transportmittel für Hormone, Energie liefernde Stoffe, Abbauprodukte,
Wirkstoffe und für Sauerstoff zur Energiegewinnung.
Vor der Beschreibung des Blutkreislaufes 1628 durch
Wiliam Harvey (1578-1657)gab es schon Vorarbeiten u.a. von Galenos (129-216)
und im 13. Jahrhundert von dem arabischen Arzt und Anatom Ibn an-Nafis.
Erythrocyten und
der Sauerstofftransport
Die roten Blutkörperchen oder Erythrocyten geben
dem Blut die charakteristische Farbe. Der rote Farbstoff ist das Hämoglobin
(abgekürzt Hb) ( Abb.3) das Eisen im Hämoglobin ist
zweiwertig. Zur Unterscheidung der Wertigkeit des Eisens werden auch die
Bezeichnungen: Ferro-Hämin (Fe2+) und Ferri-Hämin (Fe3+)
verwendet. Der farblose Eiweißanteil des Hämoglobins ist das Globin, das seinen
Namen von der Form der Erythrocyten, dem Kügelchen (lat.globulus), bekommen
hat. Es setzt sich zusammen aus 4 Proteinketten, d. h. aus je 2 α-Ketten und 2 β-Ketten. Das Hämin (Abb1) bezeichnet man als
prosthetische Gruppe (griech.prostheos, angebunden); es ist ein Komplex (lat.
complexus, zusammenhängend) mit Eisen als Zentralatom, das quadratisch umgeben
und gebunden ist über die 4 Stickstoffatome des Porphyrins (griech. porphyreos,
purpurrot, Farbe der Purpurschnecke) (Abb.2).
Man bezeichnet Komplexe, bei denen ein Ligand (lat. ligare, binden) über zwei
oder mehr Koordinationsstellen an das Zentralatom gebunden sind als
Chelatkomplexe (griech. chele, Schere eines Krebses;). Über die vier
Stickstoffe bindet das Pophyrin an das Zentralatom Eisen ; einen solchen
Liganden bezeichnet man als 4 zähnig. Dieser oktaedrische (ein Oktaeder ist ein
Körper mit 8 Flächen und 6 Ecken). Komplex ist der farbgebende Teil des
Hämoglobins. Im Hämoglobin nimmt das Imidazol eines Histidins im Globin eine
axiale Koordinationsstelle am Eisen ein (Abb.3) und
verbindet so beide Teile. Die andere axiale Koordinationsstelle nimmt zunächst
ein Wassermolekül ein, das in der Lunge durch ein Sauerstoffmolekül
ausgetauscht wird. Dieser Komplex ist die Transportform des Sauerstoffs, der
auch als Oxyhämoglobin bezeichnet wird. Das aus der Lunge kommende mit
Sauerstoff beladene Blut, das arterielle Blut, ist hell scharlachrot. Nach
Abgabe des Sauerstoffs hat das venöse Blut eine purpurrote Farbe.
1960 fanden Linus Pauling und Mitarbeiter keine Unterschiede beim Hämoglobin
von Menschen, Gorillas und Schimpansen. Das Bauprinzip des Hämoglobins ist bei
allen Säugetieren gleich.
1843 kristallisierte der Professor der Anatomie Ludwig Teichmann-Stawiarski
(1823-1895) in Krakau den Farbstoff des Blutes nach Abspaltung des Globins als
salzsaures Hämin (Abb.1). Da die Reaktionen zur Gewinnung
der Teichmann’schen Kristalle bei Gegenwart des Luftsauerstoffes durchgeführt
werden, wird das Zentralatom Eisen2+ zu Eisen3+ oxidiert.
Die charakteristischen Kristalle (braune rhomboedrische Täfelchen) dienen noch
heute zum Nachweis von Blutspuren.
Das Hämin ist auch die prosthetische Gruppe in Myoglobin (griech. myos,
des Muskels) sowie verschiedenen Cytochromen (griech. chroma, Farbe ).
Myoglobin ist das „Hämoglobin“ der Herz- und Skelettmuskelzellen von
Säugetieren und dient als Sauerstoffspeicher, es ist der rote Muskelfarbstoff.
Es gibt dem Fleisch die rote Farbe. Wale haben einen 5-10 mal so hohen
Myoglobingehalt in ihren Muskelfasern als Landsäugetiere. Man vermutet, dass
das Myoglobin als Sauerstoffreservoir dient. 1958 klärt John Kendrew die
Struktur des Myoglobins mit Hilfe der
Röntgenstrukturanalyse auf. Das Globin des Myoglobins besteht aus einer einzigen Kette von 153 Aminosäuren.
1959
klärte Max Perutz die Struktur des Hämoglobins ebenfalls mittels der
Röntgenstrukturanalyse auf. Das Globin des Hämoglobins besteht aus insgesamt 4
Proteinketten davon zwei α-Ketten aus 141 Aminosäuren und zwei
β-Ketten aus 146 Aminosäuren.
Beide Forscher erhielten 1962 den Nobel-Preis für
Chemie.
Das Globin des
Myoglobins ist ein einkettiges Protein aus153 Aminosäuren. Hämoglobin und
Myoglobin wurden von Perutz und Kendrew eingehend mit Hilfe der Röntgenstrukturanalyse
untersucht. Sie erhielten dafür 1962 den Nobelpreis für Chemie.
Cytochrome (griech.chroma, Farbe)sind farbige Proteine (Chromoproteine), die
als wesentliche Katalystoren für Redoxreaktionen bei biochemischen Vorgängen,
wie Zellatmung und der Photosynthese wirken.
Blutgifte
Von den Giften, die die Blutbildung (Erythopoese) ( gr.
poiisis, bilden) beeinträchtigen (z.B. Benzol oder Dioxin) sei hier abgesehen.
Durch die Oxidation des Eisens im Hämin zu Eisen3+ wird
Methämoglobin (abgekürzt MetHb) gebildet (griech. met(a), nachher anders ). Es
kann wohl Sauerstoff binden, aber in der Zelle nicht wieder wie normales
Hämoglobin abgeben. Bei längerer Lagerung von Fleisch an der Luft färbt
sich dieses grau, auch hier liegt eine Oxidation des zweiwertigen Eisens im
Myoglobin vor. Diese Oxidation des Fe2+ kann durch anorganische
Oxidationsmittel wie z. B. Alkalichlorat oder -Nitrit bewirkt werden. Nitrat in
Trinkwasser oder Gemüse kann mikrobiologisch zu Nitrit reduziert werden.
Methämoglobinbildung kann auch durch aromatische Amino- und Nitroverbindungen
wie z. B. Anilin, Phenylhydrazin und Nitrobenzol ausgelöst werden.
Pökelsalz, das zum Haltbarmachen von Fleisch verwendet wird, enhält neben
Kochsalz 0,4- 0,5% Nitrit. Aus Nitrit wird im sauren Milieu im Fleisch
Stickstoffmonoixid gebildet, das die Stelle des Sauerstoffs im Myoglobin
einnimmt und Nitrosylmyoglobin bildet, ( das auch Nitrosomyoglobin genannt
wird). Es hat eine beständige rosarote Farbe; man spricht daher von Umrötung
beim Pökelvorgang.
Ein gefürchtetes Blutgift ist das gasförmige und geruchlose Gas Kohlenmonoxid
(CO). Es entsteht bei der unvollständigen Verbrennung und ist auch im
Zigarettenrauch vorhanden. Es hat eine viel größere Affinität (325 x) zum
Hämoglobin als der Sauerstoff und blockiert dessen Bindungsstelle. Ein Gehalt
von 0,4% ist innerhalb einer Stunde tödlich. Stickstoffmonoxid (NO) kann
ebenfalls die Position des Sauerstoffs am Hämoglobin einnehmen, und außerdem
die Oxidation zu Methämoglobin bewirken.
Die Giftwirkung des Cyanids beruht auf der Blockade der Sauerstoff –
Bindungsstelle in der Cytochrom-c-Oxidase, dadurch kommt die Zellatmung zum
Erliegen, mit der Folge einer inneren Erstickung.
Ein weiterer Mechanismus von Blutgiften Hämotoxinen (gr.toxikon. Gift) )
ist die Hämolyse (gr. lysis, Auflösung), das ist die Zerstörung der
Erythrocyten, so dass Hämoglobin austreten kann. Das bedeutet eine Verkürzung
der Lebensdauer der roten Blutkörperchen. Zu stark hämolytischen Substanzen
zählen: Detergentien, Saponine sowie Schlangen- und Insektengifte.
Auch bei Malaria
werden rote Blutkörperchen zerstört.
Die Giftwirkung des übel riechenden Gases Schwefelwasserstoff beruht auf einer
Zerstörung des Hämoglobins im Zusammenhang. Außerdem wird vermutet, dass
schwermetallhaltige Enzyme, die der Sauerstoffübertragung dienen, inaktiviert
werden.
Bluterguss
Normalerweise fließt das Blut in Adern, also Blutgefäßen,
an den vom Herzen kommenden, den Schlagadern, kann man den Puls des Herzens
fühlen, sie werden Arterien (griech. arteria, „mit Luft gefüllt“ entsprechend
der Vorstellung im griech. Altertum) genannt, die Blutgefäße, für Blut, das
seinen Sauerstoff abgegeben hat, werden Venen (lat. vena, Blutader)
genannt.
Blaue Flecke können verschiedene Ursachen haben: Sturz, Schlägerei, auch als
Folge einer Blutentnahme. Der Grund für den Farbfleck ist immer gleich: Blut
ist aus den Blutgefäßen in das Weichteilgewebe ausgetreten. Er ist bei einer
Tiefe von 0,5 bis 2 mm durch die Haut sichtbar. Mediziner bezeichnen einen
solchen Fleck als Hämatom (neulatein d.h. nach dem 13/14.Jh) oma aus dem
Griechischen übernommene Endung sächlicher Substantive aus der Medizin, meist
mit der Bedeutung 'Geschwulst'. Ausgehend vom Hämoglobin, könnte man rote
Flecke erwarten. Der rote langwellige Anteil des Lichts wird stärker absorbiert
als der blaue kurzwelligere, der tiefer eindringt und schließlich vom Hämatom
gestreut und reflektiert wird, das dadurch blau erscheint. Die gleiche
Erklärung gilt für das blaue Aussehen von Adern.
Der blaue Fleck, der besonders am Auge, auch Veilchen genannt wird, wenn die
Ursache eine Schlägerei war, verfärbt sich über grün nach gelb-braun als Folge
des Abbaus von Hämin ( Abb.1 ) nach Abspaltung von Eisen
und des Globins über das grüne Biliverdin (Abb.4) zu
dem rot-gelb-braunen Bilirubin (Abb.5) (lat.
bilis, Galle; viridis, grün; ruber, rot). Der erste Schritt ist ein oxidativer
Angriff am Porphyrinringsystem (s.Abb. 3) an der
mit einem Pfeil bezeichneten Stelle unter Verlust des
Methin-C-Atoms, es bildet sich Biliverdin (Abb.4)
Die Reduktion des Biliverdins zum Bilirubin (Abb.5)erfolgt
an der mit bezeichneten Doppelbindung. Bilirubin ist schwerlöslich.
Für den Transport wird es löslich gemacht entweder durch die Protein Albumin
und dann als primäres Bilirubin bezeichnet. Oder es wird in der Leber mit
Glucuronsäure (Abb.6) konjugiert: Eine oder auch beide
Carboxylgruppen des Bilirubins werden mit der dem Ringsauerstoff benachbarten
Hydroxylgruppe der Glucuronsäure verestert, und dann sekundäres Bilirubin
genannt. Die gelbliche Färbung des Blutserums wird von diesem gelöstem
Bilirubin verursacht. Bili- in den Namen der Farbstoffe deutet an, dass sie in
die Gallenflüssigkeit ausgeschieden werden, ihr die gelblich grüne Farbe
erteilen, und zusammenfassend als Gallenfarbstoffe bezeichnet werden. Die Gallenflüssigkeit
wird in den Zwölffingerdarm abgegeben. Das sekundäre Bilirubin wird im Darm
bakteriell entkonjugiert und weiter über farbloses Urobilinogen ( griech. uron,
Harn, und genein, bilden) zu Urobilin und weiter zu braunrotem
Stercobilin umgesetzt, diese Abbauprodukte werden wie das Bilirubin wieder
resorbiert und erneut in die Gallenflüssigkeit ausgeschieden wird. 20% der
Gallenfarbstoffe unterliegen so dem enterohepatischen (griech. hepar, Leber;
enderon, Darm) Kreislauf, 80% werden mit dem Kot ausgeschieden, für dessen
braune Farbe das Stercobilin (Abb.7)(lt. stercus,
Exkrement) verantwortlich ist. Die resorbierten Hämoglobin-Abbauprodukte werden
zum Teil auch in den Harn ausgeschieden und erteilen ihm die gelbe Farbe. Die
Farbstoffe im Harn werden zusammenfassend als Urochrome (griech. uron, Harn)
bezeichnet, dabei ist zu beachten, dass der Begriff nicht für eine einheitliche
Stoffgruppe steht. Außerdem können auch Stoffwechselprodukte von
Nahrungsbestandteilen und Medikamenten zur Farbe des Harns beitragen.
Die Farbintensität der blauen Flecke lässt kontinuierlich nach, da die
Abbauprodukte abtransportiert werden. Ein Hämatom ist in der Regel nach 1 bis 3
Wochen verschwunden. Da der weitere Abbau und Abtransport der einzelnen
Abbauprodukte mit individuellen Geschwindigkeiten erfolgt, werden
Überlagerungen der Farbeffekte beobachtet. Der beschriebene Abbau des Hämins
ist kein Sonderfall bei blauen Flecken. Rote Blutkörperchen haben eine
Lebensdauer von etwa 120 Tagen. Sie werden in der Milz und der Leber abgebaut.
Die Aminosäuren des Globins werden dem Körper wieder zur Verfügung gestellt;
ebenso das Eisen, das gespeichert werden kann.
Bei stark erhöhtem Bilirubinspiegel im Blut, wird es durch die Haut und die Lederhaut
der Augen als gelbe Farbe sichtbar und als Gelbsucht oder Ikterus (lat.
icterus) bezeichnet.
Bei Neugeborenen ist es ein natürlicher Vorgang, dass fetale Erythrocyten
vermehrt abgebaut und durch neu gebildete ersetzt werden. Dadurch kommt es
zwischenzeitlich zu massiv erhöhten Bilirubin- Werten, die als Gelbsucht
sichtbar werden. Gelbsucht bei Erwachsenen kann dem Arzt Hinweise auf
verschiedene Störungen geben. Die Phototherapie mit kurzwelligem Licht
hat man bis 1984 mit einer vermehrten Photooxidation zu erklären versucht. Das
Licht aber bewirkt eine Isomerisierung von 2 Doppelbindungen zu Lumirubin, das
besser abtransportiert werden kann.
andere Porphyrine und
porphyrinverwandte Verbindungen
Porphyrine sind lebenswichtige Verbindungen, die von fast
allen Lebewesen gebildet werden, da sie für die Zellatmung notwendig sind. Die
Biosynthese des Tetrapyrrols Porphyrin geht aus von 5-Aminolävulinsäure. Das
zentrale Zwischenprodukt ist Protoporphyrin IX (griech. proto, erster ; bzw.
Ur-... ) (Abb. 8) in dem schon das aromatische
18 π- System mit 4 Pyrrolringen, die über 4 Methin-Gruppen verbunden sind,
vorhanden ist. Auffällig ist die Ähnlichkeit von Hämin (Abb.1)
mit Chlorophyll (griech. chloros, hellgrün; phyllon, Blatt, Laub) (Abb.9), in dem Magnesium2+ das Zentralatom im
ebenen Pophyrin-Liganden ist. Die peripheren Substituenten sind zum Teil
verändert, was sich in den Absorptionsspektren widerspiegelt, die zur
Unterscheidung der verschiedenen Chlorophylle dienen. Außerdem ist die CH2-CH2-COOH
–Gruppe am C17 (Nummerierung s. Abb.2) mit dem
ungesättigten Diterpenalkohol Phytol (Abb.10) (griech.
phyton, Pflanze, Gewächs) verestert.
1940 hat Hans Fischer, München (1881 -1945) die Struktur des Chlorophylls
aufgeklärt. Er hatte 1930 den Nobelpreis für die Synthese des Hämins erhalten.
Er hat weiter über die Gallenfarbstoffe gearbeitet und 1942 Bilirubin
synthetisiert.
Cobalamin ist der Träger des Spurenelements Cobalt. Es wird auch als Vitamin B
12 oder nach seiner Funktion als Coenzym B 12 bezeichnet. Im Cobalamin ist
Corrin (Abb.11) (lt. corona, Krone) der ebenfalls
vierzähnige Chelat-Ligand für Cobalt2+, das ebenfalls wie das Eisen
im Hämin oktaedrisch umgeben ist.
Corrin ist verwandt mit Porphyrin: es besteht aus vier reduzierten
Pyrrol-Untereinheiten, von denen zwei direkt miteinander verbunden sind. Die
anderen drei sind über 3 Methin- Brücken verbunden. Corrin ist nicht so eben
wie Porphyrin.
Es wird weder von Pflanzen noch Tieren gebildet, sondern von Mikroorganismen,
die in den Magen -Darm -Kanal eingeschleppt werden und sich dort symbiotisch ansiedeln.
Auch die industrielle Herstellung des Vitamins B 12 bedient sich der
Mikroorganismen, es fällt meist als Nebenprodukt bei der Herstellung von
Antibiotika an. Ein Verfahren zur Herstellung von Vitamin B 12 mittels Bacillus
megaterium ist patentiert worden.
Auf den ersten Blick scheint auch Hämocyanin zu dieser Verbindungsgruppe zu
gehören. Der Präfix Häm soll aber nur ausdrücken, dass dieser blaue (griech.
cyanos, himmelblau) Blutfarbstoff dem Sauerstofftransport bei Gliederfüßlern
(Krebse, Spinnen und Insekten) und bei Weichtieren (Muscheln, Schnecken und
Kopffüßler) dient. Der Sauerstoff wird von zwei Kupferionen gebunden, die
von Aminosäuren komplexiert werden und „ diesem Blut“ die blaue Farbe
verleihen.
|
Unser Blut
setzt sich zusammen aus: |
|
48,5
% Wasser (Blutflüssigkeit oder Blutplasma) |
|
Österreichisches Rotes Kreuz |
salzsaures Hämin, oder Teichmann’sche Kristalle
|
|
Hämoglobin
zu Abb.3 der Pfeil berzeichnet die Position des
oxidativen Angriffs zur Bildung von Biliverdin Abb.4.
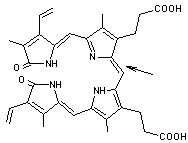
Abb.4
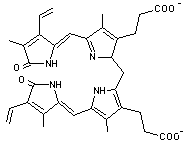
Biliverdin
Zu Abb.4
Der Pfeil bezeichnet die Doppelbindung, die zur Bildung von Bilirubin
Abb.5 hydriert (reduziert) wird.
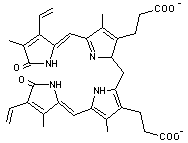
Bilirubin
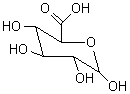
Glucuronsäure
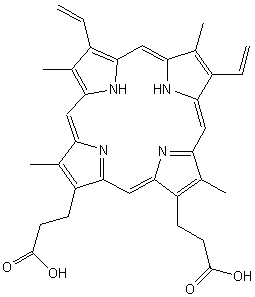
Protoporphyrin IX
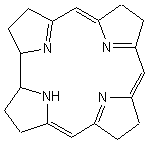
Corrin