ECCHYMOSES
(Wolfgang
WERNER – Münster)
La
structure et la fonction de l'hémoglobine sont
présentées. Sa dégradation est également suivie. Des complexes similaires
existant dans la nature sont inclus. Les termes techniques et les noms propres
sont rendus compréhensibles par des indications sur leur étymologie.
LE SANG
« Le
sang est un liquide à part » fait dire Goethe à Mephisto dans Faust I.
Nous
avons un rapport émotionnel au sang, qui peut beaucoup varier d’un individu à
l‘autre. Il en est de même, d’un point de vue scientifique, pour la
composition du sang ; l’ensemble des propriétés du sang constitue l’hématologie
(gr. haima, le sang, et logos la science).
Le
sang est un ensemble de globules rouges nommés érythrocytes (gr. Erythros, rouge et cytis, cellule), de globules blancs nommés leucocytes (gr. Leukos, blanc) et de plaquettes
sanguines, en suspension dans un liquide appelé plasma.
Le
pourcentage en volume des composants cellulaires (surtout des érythrocytes (Tab. 1)) par rapport au volume total du sang est nommé hématocrite
(abréviation: hct) (gr. krites,
juge). Cette valeur est chez les hommes de 43 à 50 % et chez les femmes de 35 à
44%. Cette valeur est aussi un indice pour la viscosité du sang.
Le
plasma représente 50% environ du volume sanguin, c’est une solution aqueuse de
protéines colloïdales et d’électrolytes. La proportion relative de ces
électrolytes est voisine de celle des composants de l’eau de mer.
La
quantité de sang d’un adulte est de 5 à 6 litres. Le sang est aspiré et pompé
par le cœur en circuit fermé, il est le moyen de transport pour les hormones et
les substances capables de livrer de l’énergie et pour les métabolites ainsi
que pour l’oxygène nécessaire au métabolisme.
Les
travaux de Galien (129 – 216) et au 13ième siècle ceux du médecin et
anatomiste arabe Ibn al Nafis, précèdent la description de la circulation du
sang en 1628 par William Harvey (1578 – 1657).
LES ÉRYTHROCYTES ET LE TRANSPORT DE L’OXYGÈNE
Les
globules rouges ou érythrocytes donnent au sang sa couleur caractéristique. Le
colorant rouge est l’hémoglobine (illustration 3), en
abrégé Hb.
La
partie incolore protéinique de l’hémoglobine est la globine qui doit son nom à
la forme des érythrocytes (lat. globulus,
sphère). La globine se compose de 2 chaînes a et de 2 chaînes b.
Le
groupe prosthétique (gr. prosthetos,
lié, ajouté ) est nommé hème (illustration 1a), il
s’agit d’un complexe (lat. complexus,
entouré, embrassé) fer-porphyrine ; le fer est au centre, entouré en carré
par les 4 atomes d’azote de la porphyrine (illustration 2) (gr. porphura,
pourpre , colorant d’un escargot de la méditerranée de l’espèce murex).
Remarque : Pour
distinguer la valence du fer on utilise aussi les noms ferrihème (Fe3+)
ou hématine (illustration 1b) et ferrohème (Fe2+)
ou simplement hème.
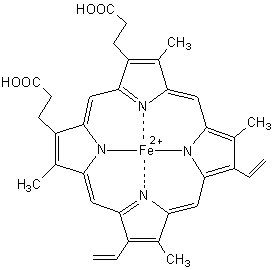
Le fer
dans l’hémoglobine est sous forme d’ions Fe2+.
Les
complexes dont un ligand (lat. ligare,
lier) occupe deux ou plusieurs positions de coordination (lat. coordinatio, arrangement) autour du
métal sont appelés des chélates (gr. khele
pince).
Un
ligand tel que la porphyrine a le nombre de coordination 4.
Le
complexe hème est de structure octaèdrique (un octaèdre est un volume à 8 faces
et 6 sommets), il est le principe colorant de l’hémoglobine.
L’imidazole
d’une histidine de la globine occupe une position axiale par rapport au fer (illustration 3) et lie ainsi l’hème et la globine. L’autre position axiale est d’abord
occupée par une molécule d’eau ;
elle est dans les poumons remplacée par une molécule d’oxygène.
Le sang
venant des poumons, chargé d’oxygène, est appelé sang artériel et est rouge écarlate.
Après la libération de l’oxygène, le sang est appelé sang veineux et prend une
couleur pourpre.
Vers
1960 Linus Pauling (1901-1994) et ses collaborateurs trouvèrent que
l’hémoglobine chez l’homme, le gorille et le chimpanzé étaient identiques. La
structure de l’hémoglobine est la même pour tous les mammifères.
En 1853
le professeur Ludwig Teichmann-Stawiarski (1823-1895) cristallisa à Cracovie
l’hème après élimination de la globine. La cristallisation a lieu en présence
de l’oxygène de l’air, le fer (II) est oxydé en fer (III), l’hème est alors
devenue de l’hématine dont le chlorhydrate est appelée hémine (illustration 1c).
L’hème
est également le groupe prosthétique de la myoglobine (gr. myos, muscle) et de
certains cytochromes (gr. chroma, couleur).
La
myoglobine est l’hémoglobine dans les
muscles et dans le myocarde. Elle donne la couleur rouge à la viande. Les fibres musculaires de la baleine ont un
taux de myoglobine 5 à 10 fois plus
élevé que celui des mammifères terrestres, elle sert de
réservoir d’oxygène. En 1958
John Kendrew élabore la structure de la myoglobine par cristallographie par
rayons X ; la globine de la myoglobine est une protéine avec une chaîne
composée de 153 acides aminés.
Max Perutz a
étudié la structure de l’hémoglobine en 1959 ; il y a 4 chaînes
protéiniques qui forment la globine, les 2 chaînes α se composent de 141
α aminoacides, et les deux chaînes β se composent de 146 α
aminoacides. Les deux chercheurs ont reçu le Prix Nobel de Chimie en 1962.
Les cytochromes sont des protéines colorées, des
chomoprotéines qui servent de catalyseurs essentiels à des oxydoréductions dans
des réactions biochimiques, comme la respiration cellulaire et la
photosynthèse.
TOXINES POUR LE SANG
Le
benzène et la dioxine gênent l’érythropoïèse (gr. poiis, action de
faire : c’est
la formation du sang).
Par
oxydation du fer(II) de l’hémoglobine en fer (III) il résulte de la
méthémoglobine (abréviation: MetHb) qui peut également accepter de l’oxygène,
mais n’a pas la propriété de le transmettre à la cellule comme le fait le
fer(II) de l’hémoglobine.
Par
contact prolongé avec l’air, la viande
se colore en gris. Ici aussi il s’agit de l’oxydation du fe(II), cette fois
dans la myoglobine.
L’oxydation
peut être provoquée par des oxydants minéraux, comme par exemple les chlorates
et les nitrites alcalins. Les nitrates dans l’eau potable ou dans les légumes
peuvent être réduits par voie microbiologique en nitrites.
La
formation de méthémoglobine peut être provoquée également par des composés
aminés et nitrés, aromatiques comme par exemple l’aniline, la phénylhydrazine
et le nitrobenzène.
Un
poison redouté est le monoxyde de carbone (CO), gaz incolore et inodore. Il se
forme lors d’une combustion incomplète et est présent aussi dans la fumée de
cigarette. Ce gaz a une affinité beaucoup plus grande (325 fois ) pour
l’hémoglobine que l’oxygène dont il empêche la fixation. Un taux de 0,4% dans l’air peut être mortel en l’espace d’une
heure.
Le
gaz monoxyde d’azote peut aussi occuper la position de l’oxygène dans
l’hémoglobine et engendrer la transformation de l’hémoglobine en
méthémoglobine.
L’effet toxique du cyanure résulte du blocage
de la position de l’oxygène dans la cytochrom-c-oxydase empêchant ainsi la
respiration cellulaire et provoquant l’étouffement interne.
Un
autre mécanisme d’empoisonnement par les hématoxines (gr.toxicon, poison) est
l’hémolyse, c’est à dire la destruction des érythrocytes, au cours de laquelle
l’hémoglobine est libérée et qui entraîne une diminution de la durée de vie des
globules rouges. On trouve parmi les saponines et des agents tensioactifs, des
substances à fortes propriétés
hémolytiques. C’est
aussi le principe d’action des venins des serpents et d’insectes ; ainsi dans
le cas du paludisme les globules rouges atteints sont détruits.
L’effet
toxique du sulfure d’hydrogène (H2S), gaz malodorant, est lié à la
destruction de l’hémoglobine ; dans ce cas on soupçonne que les enzymes
qui servent à transmettre l’oxygène sont désactivés.
Dans
la salaison, le sel qui sert à conserver la viande, contient à part le chlorure
de sodium 0,4 à 0,5% de nitrites. À partir des nitrites se forme dans le milieu
acide de la viande du monoxyde d’azote qui prend la place de l’oxygène dans la
myoglobine pour donner la nitrosomyoglobine de couleur rose permanente.
HÉMATOMES
En
général le sang coule dans le système vasculaire. Les vaisseaux qui viennent du
coeur et qui laissent sentir le pouls, sont appelés artères (gr. arteria,
rempli d’air selon ce qu’on imaginait dans
l’antiquité). Les vaisseaux allant vers le cœur, transportant le sang
ayant cédé l’oxygène, sont appelés veines (lat. vena).
Les
taches bleues peuvent avoir des origines multiples. La cause est toujours la
même : Il y a du sang sorti du système vasculaire dans les tissus et cela
devient visible à l’œil nu lorsque le sang se trouve à une profondeur allant de
0,5 à 2 mm sous la peau.
Le
terme médical d’hématome vient du nouveau latin après le 13/14ième
siècle et la terminaison grecque « om » est utilisée pour désigner
des renflements.
À
cause de l’hémoglobine on pourrait s’attendre à des taches rouges. Mais
les grandes longueurs d’ondes de la
lumière sont plus absorbées que les longueurs d’ondes courtes qui donnent une
lumière plus dispersée ; ainsi l’hématome apparaît bleu, les veines aussi pour
la même raison ; le phénomène est
moins visible pour les artères qui se trouvent plus en profondeur.
L’œil
au beurre noir, dont l’origine est souvent une bagarre, les taches bleues de chutes
ou de prises de sang, changent de couleur et deviennent vertes puis jaunes
brunâtres. C’est le résultat de la
dégradation de l’hémoglobine (illustration 3) qui après
avoir cédé le fer et la globine se transforme en biliverdine verte (illustration 4) puis en bilirubine (illustration 5) de couleur rouge, jaune à brun (lat.
bilis, bile).
L’étape
initiale est l’attaque oxydative dans le système porphyrinique (illustration
3) d’un groupe méthine (-C=), il en résulte la biliverdine (illustration 4). La réduction de la biliverdine pour
donner la bilirubine a lieu sur la
double liaison marquée par une flèche dans l’illustration
4. La bilirubine est peu soluble. Pour le transport elle est solubilisée en
s’associant avec de l’albumine et est alors nommée bilirubine primaire, ou bien
un de ses groupes carboxyliques est estérifié par un des groupes hydroxyliques
de l’acide glucuronique (illustration 6), elle est alors
appelée bilirubine secondaire.
La
coloration jaune du sérum sanguin est due à ces formes solubilisées de la
bilirubine. Le préfixe bili- dans ces noms s’explique par leur évacuation dans
le liquide biliaire. Le liquide biliaire est sécrété dans le duodénum. La
bilirubine y est libérée par voie bactérienne et transformée par l’urobilinogène incolore (gr. uron,
urine; genesis,naissance) en urobiline et finalement en stercobiline
rouge-brun (lat. stercus, excrément).
Ces
produits de dégradation comme la bilirubine sont résorbés et sécrétés à nouveau dans la liqueur biliaire. 20% des colorants
biliaires sont ainsi soumis au cycle entérohépatique (gr. hepar, le foie;
enteron, l’intestin) et 80% sont éliminés par les selles dont la couleur est
due à la stercobiline.
Les
produits de dégradation de l’hémoglobine résorbés sont en partie excrétés par
l’urine et lui donnent la couleur jaune. Les colorants de l’urine sont parfois
rassemblés sous le nom d’urochromes, nom qui ne représente pas un groupe
chimique défini. De plus, quelques produits du métabolisme de la nourriture et
des médicaments peuvent contribuer à donner sa couleur à l’urine.
L’intensité
des taches bleues diminue continuellement, puisque les produits de dégradation
sont éliminés progressivement. Un hématome a disparu en général après une à
trois semaines. Puisque la dégradation et le transport des produits de
dégradation n’ont pas tous lieu à la même vitesse, on observe aussi des superpositions de couleurs.
Cette
dégradation de l’hémoglobine n’est pas l’apanage des seules taches bleues. Les
globules rouges ont une demie vie de 120 jours environ, après ils sont dégradés
dans la rate et dans le foie. Les aminoacides de la globine sont mis à la
disposition de l’organisme ainsi que le fer qui peut également être stocké. Si
le taux de bilirubine est très élevé, on voit la couleur jaune à travers la
peau et dans la membrane sclérotique de l’œil, on parle alors d’ictère ou de
jaunisse.
Chez
le nouveau né c’est un procédé normal puisque les érythrocytes fœtaux sont
dégradés et remplacés par des érythrocytes d’adultes nouvellement formés. C’est
pourquoi apparaissent entre temps des
taux de bilirubine élevés. L’ictère chez les adultes peut être le signe, pour
le médecin, d’un dérèglement.
Jusqu’en
1984 on expliquait l’effet de la
photothérapie sur l’ictère par la photo-oxydation ; en fait la lumière provoque une isomérisation de deux doubles
liaisons pour former de la lumirubine qui peut être plus facilement évacuée.
AUTRES PORPHYRINES ET COMPOSÉS VOISINS.
Les
porphyrines, formées pratiquement par tous les organismes, sont des composés
essentiels pour la vie parce qu’ils jouent un rôle important dans respiration
cellulaire. La biosynthèse de la porphyrine, système à quatre cycles
pyrroliques, se fait à partir de l’acide 5-amino-lévulinique. Le produit
intermédiaire est la protoporphyrine IX (gr. proto, premier) (illustration 8), qui possède déjà le système
aromatique de 18 électrons π grâce à quatre noyaux pyrroliques liés par
quatre groupes méthynes.
Il
est bien visible que l’hème (illustration 1a) et la
chlorophylle (illustration 9) (gr. chloro, vert ; phyllon,
feuille) sont très semblables, sauf que la chlorophylle contient du magnésium au centre à la place du fer. Les
substituants périphériques sont en partie modifiés, ce que reflètent les
spectres d’absorption qui servent à distinguer les différentes molécules de la
chlorophylle. En plus le groupe -CH2-CH2-COOH
en position 17 (pour la numération voir l’illustration 2) est estérifié par
l’alcool diterpénique saturé, le phytol (gr. phyton,
plante).
C’est
Hans Fischer (1881-1945) qui a élucidé la structure de la chlorophylle en 1940
à Munich. En 1930 il avait reçu le prix Nobel pour la synthèse de l’hémine. Il
a continué à travailler sur les colorants biliaires et a synthétisé en 1942 la
bilirubine.
La
cobalamine est le porteur de l’oligoélément cobalt. On la désigne aussi comme
vitamine B12 ou selon sa fonction, coenzyme B12. Dans la
cobalamine c’est la corrine (illustration 11) (lat.
corona, couronne) qui est le ligand à quatre positions pour le cobalt Co2+,
comme pour le fer dans l’hème.
La
corrine est apparentée à la porphyrine : elle est constituée de quatre pyrroles
réduits dont deux sont directement reliés, les trois autres étant liés par
trois groupes méthynes. La corrine n’est pas aussi plane que la porphyrine ;
elle n’est produite ni par les plantes ni par les animaux, mais par des
microorganismes, qui sont introduits dans le système digestif et qui y vivent
en symbiose. La production industrielle de la vitamine B12 utilise
également des microorganismes ; elle est un produit secondaire de la production
microbiologique des antibiotiques. Un procédé de fabrication de la vitamine B12
utilisant le bacillus megaterium a
été breveté.
Au
premier coup d’oeil l’hémocyanine semble faire part de ce groupe de composés.
Le préfixe hém- veut simplement exprimer ici que ce colorant bleu (gr. cyaneos,
bleu) sert au transport de l’oxygène chez les arthropodes (ce sont les
écrevisses, les araignées et les insectes) et les mollusques (ce sont les
moules, les escargots et les céphalopodes). L’oxygène est lié à deux atomes de
cuivre complexés par deux acides aminés, qui donnent à ce « sang » la
couleur bleue.
|
Composition
de notre sang : |
|
48,56%
d’eau (liquide sanguin ou plasma sanguin) 1,08 % de
lipides, sucres et sel 4,4% de
protéines 42,7% de
globules rouges (érythrocytes) 0,06% de
globules blancs (leucocytes) 2,14% de
plaquettes sanguines (thrombocytes) |
|
Croix
Rouge d’Autriche |
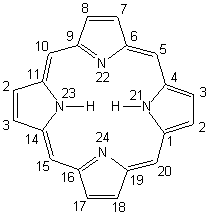
iIllustration 1a
illustration 1b
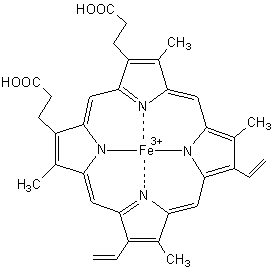
Hème ( ou noyau hème) Hématine
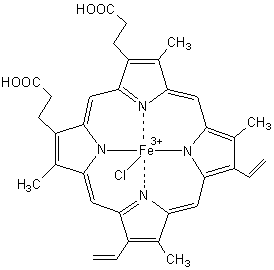
Hémine
(chlorhydrate d’hématine),ou Cristaux de Teichmann

Hémoglobine
La flèche qui ne pointe pas vers le fer, indique la position d’attaque
oxydative pour la formation de la Biliverdine (illustration 4)

Imidazole
de l’histidine dans la globine
La flèche indique
la position de la fixation sur l’hème.
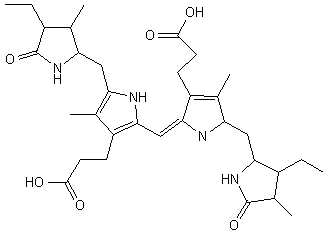
illustration.4
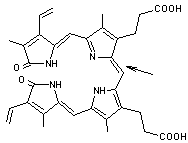
Biliverdine
La flèche indique la double liaison, qui est hydrogénée (réduite) pour donner la Bilirubine (illustration 5)
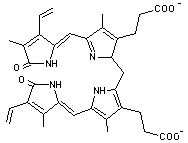
Bilirubine
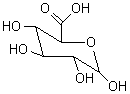
Acide Glucuronique
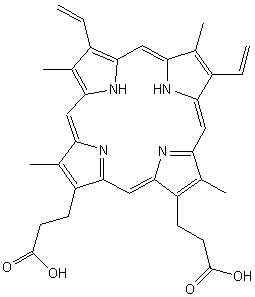
Protoporphyrine IX
Chlorophylle
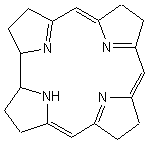
Corrine