|
Aspect: cristaux blancs, stables
à l'air et à la lumière
Masse molaire: 150,087 g.mol-1
Densité :
isomère L: 1,582
isomère DL (racémique): 1,78825
isomère méso: 1,666420
Fusion:
isomère L : 169°C (C'est l'isomère naturel)
isomère D : 172,5°C
isomère DL (racémique): 206°C
isomère méso: 147°C
pKa:
1ère acidité : pKa1=2,93
2ème acidité : pKa2=4,3
Indice de réfraction:
isomère L : nD = 1,4955
isomère méso: 1,5-1,6
Pouvoir rotatoire spécifique:
Composé naturel (L)
[a]D20=+ 11,98°
Composé (D)
[a]D20=- 11,98° (c'est l'énantiomère)
Solubilités:
Pour l'isomère naturel (L):
- dans l'éthanol: 20,4g dans 100g d'éthanol absolu à 18°C
- dans l'éther: 0,3g dans 100g d'éther à 18°C
- dans l'eau:
|
Température
|
g/100g
d'eau
|
Température
|
g/100g
d'eau
|
|
0
|
115
|
50
|
195
|
|
5
|
120
|
60
|
218
|
|
10
|
125
|
70
|
244
|
|
20
|
139
|
80
|
273
|
|
30
|
156
|
90
|
307
|
|
40
|
176
|
100
|
343
|
Remarque :
la solubilité du composé méso à 25°C est de 120g pour 100g d'eau, celle du racémique
à 25°C, 25g pour 100g d'eau.
Risques et Sécurité:
R: 36/37/38 S: 26-36
|
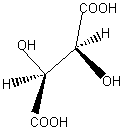
Formules:
- Moléculaire : C4H6O6
- semi-développée :
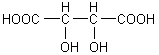
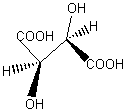
Stéréoisomère 2R,3R (dextrogyre (+)) ; isomère L.
Stéréoisomère 2S,3S (lévogyre (-)) ; isomère D.
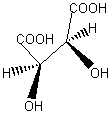
Stéréoisomère 2R, 3S (composé méso, sans action sur la lumière polarisée)
Etat naturel, utilisations:
L' acide tartrique existant dans la nature est l'isomère L(+). C'est un
composé souvent extrait des résidus naturels qui proviennent de la
vinification, par traitement exclusif par l'eau.
L'acide tartrique existe dans de nombreux fruits et en particulier dans le
raisin.
Ses utilisations sont très diverses (E334):
- dans l'alimentation:
Comme acide organique (boissons gazeuses, ou jus de fruits, confiseries et
biscuits, stabilisant du goût, du pH, de la couleur et de la valeur nutritive
de certaines conserves, émulsifiant et conservateur des pains et
viennoiseries industriels).
- dans l'industrie pharmaceutique:
Pour rendre les cachets effervescents.
- Comme réducteur (révélateur en photographie, argenture des
miroirs, antioxydant des graisses et huiles)
- Dans l'industrie des métaux (polissage) et des ciments
(retardateur de prise des plâtres et ciments).
- Le complexe de cuivre(II) et du tartrate double de sodium et
de potassium permet de solubiliser l'hydroxyde de cuivre(II) en milieu
alcalin, c'est la liqueur de Fehling qui est un réactif des aldéhydes.
- L'acide tartrique peut-être déshydraté puis
partiellement décarboxylé par KHSO4 en acide pyruvique.
Histoire:
Connu depuis l'antiquité, c'est Scheele en collaboration avec Retzius qui
parvint en 1769 à l'extraire du tartre du
vin (sel monopotassique de l'acide tartrique) en traitant celui-ci par
l'acide sulfurique.
Louis Pasteur, par une étude cristallographique des sels de l'acide
tartrique, montra dès 1848 que l'asymétrie de tels cristaux est due à
l'asymétrie des molécules.
|
 Xi
Xi