CLASSIFICATION DES
PROTEINES
1) Les structures des protéines (Rappel) :
Quatre niveaux de structure :
- Structure primaire :
Elle est définie par la connaissance de la nature des aminoacides qui
constituent la protéine et par l'ordre de leur enchaînement (séquence).
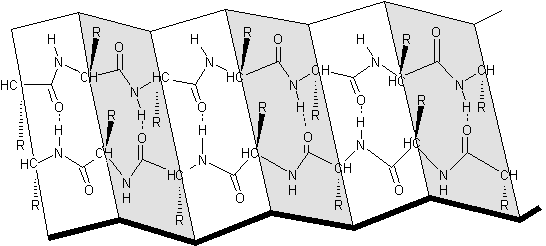
- Structure secondaire :
Elle est définie par la forme géométrique de la chaîne d'acides aminés: soit
en feuilles plissées (configuration b), soit en hélices a pour un
grand nombre d'entre elles. La structure en hélice est assurée par des liaisons
hydrogènes entre les atomes d'hydrogène d'un groupe NH d'une liaison peptidique,
et l'atome d'oxygène d'un groupe C=O d'une autre liaison peptidique.
Exemple de structure en feuilles
plissées : la fibroïne de la soie
Structure en hélice α (kératine) :

- Structure tertiaire :
Elle est définie par le plissement, l'enroulement et
les autres processus d'agrégation des polypeptides. Par exemple, pour les
protéines ayant une structure secondaire en hélice, l'axe de l'hélice n'est pas
rectiligne. Les pliures, ou l'enroulement de l'hélice sur elle-même constitue
la structure tertiaire.
- Structure quaternaire :
Souvent, des protéines sont formées de plusieurs chaînes d'acides
aminés. C'est le cas de l'hémoglobine qui contient quatre chaînes protéiques,
ou de l'insuline qui en comporte deux liées entre elles par des ponts disulfure
(S-S).L'association de ces chaînes qui chacune possède une structure
primaire, secondaire et tertiaire, constitue la structure quaternaire de ces
protéines.
2) La classification des protéines :
Elle peut se faire de différentes façons :
2-1) En fonction de la structure tertiaire :
- Protéines fibreuses : diverses hélices a sont enroulées de manière à produire une super hélice: c'est le cas de la myosine (dans le muscle), de l' a-kératine (dans les cheveux, les ongles, la laine).
- Protéines globulaires : On observe des repliements prononcés, c'est le cas de la myoglobine, de l'hémoglobine...Nombre de ces protéines réalisent des transports chimiques ou sont des catalyseurs.
2-2) En fonction de la composition :
2-2-1) Protéines simples ou holoprotéines : Elles sont composées exclusivement d'aminoacides.
2-2-2) Protéines complexes ou conjuguées ou hétéroprotéines : Dans de telles protéines on distingue deux parties :
- la partie protéique : apoprotéine.
- la partie non protéique : groupement prosthétique : il est fortement lié à
l'apoprotéine, souvent par liaison covalente et joue un rôle important dans la
fonction de la protéine. On classe les hétéroprotéines en fonction de la nature
chimique de leur groupement prosthétique.
a) Glycoprotéines
: Le groupement prosthétique est un groupement glucidique plus ou moins
important appelé glycane (voir annexe) qui a un
rôle structural ou de reconnaissance...Ces protéines sont largement répandues
dans le monde vivant.
Exemples: de
nombreuses hormones, les protéines des liquides biologiques (salive, larmes,
sang,....). Presque toutes les protéines du sang sont des glycoprotéines
(Anticorps, fibrinogène,...).
b) Protéolipides
: Le groupement prosthétique est un groupement lipidique dont le rôle est
l'ancrage des protéines aux membranes.
NE
PAS CONFONDRE AVEC LES LIPOPROTEINES, QUI SONT
DES ASSEMBLAGES NON COVALENTS IMPLIQUES DANS LE TRANSPORT DES LIPIDES DANS
L'ORGANISME.
c) Chromoprotéines
: Ce sont des hétéroprotéines colorées.
Dans
les myoglobines ou les hémoglobines
une seule chaîne peptidique (la globine) est combinée à un groupement
prosthétique (hème) logé dans un repliement de la structure tertiaire de
la globine.
Remarque: L'hème
est constitué d'un noyau porphyrine (structure plane) et d'un atome de fer
(II); ce complexe est rouge et donne sa couleur au sang :

d) Phosphoprotéines
:
Exemple :les caséines, qui
sont l' ensemble des protéines du lait.
2-3) Suivant leur rôle biologique :
a) Enzymes : Ce sont des catalyseurs de nature protéique qui catalysent les réactions biologiques et permettent à ces réactions, de la plus simple à la plus compliquée, de se produire à des températures compatibles avec la vie biologique (environ 37°C).Ils sont constitués de protéines à structure tertiaire. Ce sont des catalyseurs très spécifiques. Un enzyme donné peut ne catalyser qu'un seul type de réaction, ou ne catalyser qu'une réaction donnée pour un substrat (réactif) donné. On peut aussi avoir stéréospécificité: un enzyme peut catalyser une réaction donnée pour un seul des deux énantiomères d'un composé chiral. Le substrat doit venir se fixer en un endroit donné de la chaîne protéique appelé "site actif de l'enzyme". Chaque cellule vivante contient des milliers d'enzymes, chacun catalysant une seule réaction chimique bien précise. Citons la chymotrypsine, enzyme pancréatique constitué par une séquence de 246 aminoacides. Certains enzymes réagissent avec leur substrat seulement quand ils sont combinés avec une autre substance appelée coenzyme. En général un coenzyme n’est pas de nature protéique ; c’est une molécule organique beaucoup plus simple que l’enzyme ; le complexe enzyme-coenzyme est réversible.
Un coenzyme peut
s’associer à plusieurs enzymes et de ce fait agit sur plusieurs substrats.
Remarque : On distingue six
classes d'enzymes correspondant à six grandes catégories de réactions :
* Oxydo-réduction → oxydo-réductases
* Transfert de
groupements → transférases
* Hydrolyse → hydrolases
* Coupure de liaison → lyases
* Isomérisation → Isomérases,
synthétases
* Couplage → ligases
b) Protéines
de structure :
Elles
constituent la charpente des tissus vivants (peau,cheveux, muscles). Citons les
collagènes, les kératines et la myosine.
c) Protéines
de défense :
Citons les
immunoglobulines, protéines de la coagulation (fibrinogène, thrombine).
d) Les autres :
- Protéines régulatrices : exemple de certaines hormones telles que
l'insuline, hormone du pancréas, avec une séquence de 51 aminoacides, qui
régule le taux de sucre dans le sang ou l'ocytocyne (polypeptide avec une
séquence de 9 acides aminés) qui régule les contractions utérines lors de
l'accouchement. Citons aussi comme protéines régulatrices, les cytokines de
l'immunité....
- Protéines de transport : Protéines du plasma fixant et transportant
des molécules ou des ions d'un organe à un autre, comme par exemple
l'hémoglobine des érythrocytes, le sérumalbumine....
- Protéines contractiles ou motrices : Elles peuvent se contracter et
modifier leur forme. (Actine et myosine dans les fibres musculaires).
- Protéines de stockage : l'ovalbumine, principale protéine du blanc
d'oeuf, caséines, principales protéines du lait, et des protéines existant dans
les graines de nombreux végétaux (blé, maïs, riz).
2-4) Suivant leur
solubilité
- Albumines : solubles dans l'eau.
- Globulines : solubles dans un milieu aqueux, légèrement acide ou alcalin ou
contenant de faibles quantités de sels neutres.
- Scléroprotéines (kératines, collagènes): insolubles dans tout milieu aqueux.
Annexe :
Glycane – Liaison glycosidique
-
On appelle glycane un oligomère ou un polymère composé d'oses liés par liaisons
glycosidiques. On distingue les homoglycanes formés d'oses identiques (ex
amidon, glycogène, cellulose..) et les hétéroglycanes constitués d'oses
différents.
-
On appelle liaison glycosidique, la formation de l'acétal entre deux oses qui
implique pour l'un d'entr'eux au moins le groupement hémiacétalique.
Accès
au document du
Dr Wolfgang WERNER sur les aminoacides