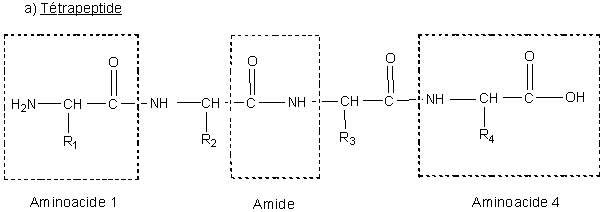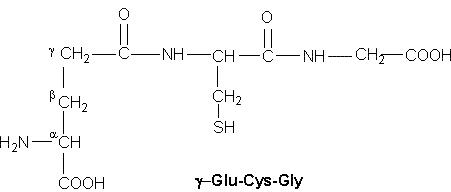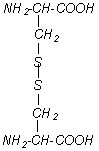LES AMINOACIDES
( Wolfgang WERNER –
Münster)
Plan de l'exposé:
Protéines, albumines, globulines
Les aminoacides en général
Différents aminoacides
Digestion et métabolisme
Les aminoacides essentiels
Figures et tableaux
Par aminoacides, on entend habituellement
les seuls acides aminés protéinogènes. C’est pourquoi, afin d’éclairer notre
propos, il nous semble nécessaire de consacrer tout d’abord quelques lignes aux
protéines.
Ces aminoacides possèdent une structure fondamentale identique et sont appelés
acides aminés naturels (figure1)
Protéines, albumines, globulines
Afin de désigner les substances primordiales dans la
construction des tissus humains et animaux, Jöns Jakob Berzelius (1779-1848) a
forgé le terme de " protéine ", (du grec proteos " le
premier, le plus important "). Ce terme fut employé pour la première fois
dans le manuel de chimie de Melchers paru en 1840.
L’appellation " blanc d’oeuf " est une dénomination issue de la vie quotidienne qui ne désigne cependant pas le blanc de l’oeuf une fois que celui-ci est cuit, mais la substance translucide d’avant la cuisson. La substance blanche de l’oeuf dur ou de l’oeuf au plat est en fait du blanc d’oeuf dénaturé, dont la structure originelle ou naturelle a été détruite par la chaleur lors de la cuisson.
L’appellation " albumine " (du latin albus, blanc) désigne, elle, un groupe de protéines présent notamment dans l’oeuf. En formant des termes composés tels que ovalbumine (du latin ovus l’oeuf) ou sérumalbumine (du latin serum) on cherche à différencier l’albumine par son origine, puisque cela est impossible à partir du seul point de fusion ou d’ébullition. Il ne s’agit pas, la plupart du temps, d’une substance unitaire. L’analyse élémentaire produit toujours des valeurs semblables et ne permet pas d’opérer une distinction. Il en est de même pour le groupe des globulines (du latin globulus, petite boule) qui a donné leur nom aux globules rouges qui apparaissent au microscope comme de petites boules. Là aussi on tente de les différencier grâce à leur origine en formant des termes composés, comme par exemple hémoglobine (du grec haima, le sang). On rencontre également des lettres issues de l’alphabet grec : le alpha (α) désigne ce qui a été découvert en premier et ainsi de suite.
Le noyau hème est un complexe fer(II)-porphyrine (du grec porphyreos, pourpre, rouge), lié à la globuline qui lui correspond. C’est ce qui confère à l’hémoglobine la couleur, caractéristique, du sang. Le noyau hème, avec l’aide de certains " domaines " de la globuline assure le transport d’oxygène dans l’organisme. Le noyau hème est d’ordinaire qualifié, tout comme d’autres groupes n’appartenant pas à la catégorie des protéines, de groupe " prosthétique " (du grec prosthetos, placé avant /devant). L’hémoglobine à l’instar de sa voisine la myoglobine (du grec myos ou du latin mus, le muscle) appartient au groupe des chromoprotéides (du grec chromos, la couleur). Les protéides sont de " petites " protéines. Toujours en ayant recours à des termes composés, on tente de les classifier : les glycoprotéides (du grec glykos, doux, sucré) contiennent du sucre, tandis que les nucléoprotéides (du latin nucleus, noyau) contiennent, elles, des acides nucléiques. Les protéides phosphorées, qui contiennent des dérivés d’acides phosphoriques se trouvent aussi bien dans le jaune d’oeuf que dans la caséine (du latin caseus, fromage). Dans ce cas il ne s’agit pas non plus de substances identiques au sens chimique du terme. Mais différencier les albumines des globulines par la probable différence de solubilité entre ces colloïdes s’avère difficile et ne permet pas de trancher avec certitude.
Cristalliser des protéines s’avère particulièrement ardu. Hofmeister réussit en 1890 à cristalliser l’ovalbumine. Les travaux menés dans les années 1925-1930 par Th. Svendberg afin de déterminer par ultracentrifugation, la masse molaire ("poids moléculaire") ont permis de prouver qu’il s’agissait dans ce cas de macromolécules. Face aux difficultés que réserve la chimie des protéines, on comprend qu’ait pu naître la controverse autour de la chimie dite organique, " organique " parce que l’on supposait que des composés organiques ne pouvaient s’obtenir que dans un organisme vivant. La synthèse de l’urée, réalisée en 1828 par Wöhler avait remis en cause la distinction entre chimie organique et chimie anorganique (dite dans un premier temps chimie non organique). L’urée était considérée, depuis sa découverte en 1773 par Rouelle, comme un composé organique.
Ce n’est qu’en 1875 que Schützenberger est parvenu à montrer que l’hydrolysat (du grec hydros, eau et lysis, coupure) des protéines contient uniquement des acides aminés d’une structure particulière (figure n°1). C’est à partir de ce constat que F. Hofmeister et Emil Fischer ont pu qualifier en 1902 les protéines de polypeptides (figure n°2), un polypeptide étant une forme particulière, du fait précisément de ces aminoacides, de polyamide(s).
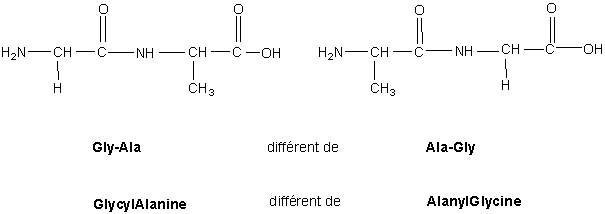
La notation des aminoacides s’effectue de la manière suivante : on isole leurs trois premières lettres(voir tableau 1) et on inscrit à la gauche de ces initiales la liaison N terminale. La séquence (du latin sequi, suivre) des acides aminés est décisive pour la structure du peptide, comme le montre l’exemple du dipeptide (figure n°2b).
Les
aminoacides en général
L’histoire des travaux sur les protéines montre bien que la
découverte des différents acides aminés naturels a pour l’essentiel eu lieu au
cours du XIXème siècle. La difficulté majeure fut de les isoler. On
ne disposait pas encore, en effet, des méthodes chromatographiques. Les
aminoacides s’obtenaient généralement à partir de l’hydrolysat acide d’une
protéine. La teneur des différentes protéines en différents aminoacides est
très variable. Actuellement on a recours à une méthode couramment utilisée par
l’industrie et qui repose sur la biotechnologie pour les produire. Les
microorganismes libèrent les aminoacides dans un milieu de culture où on peut
alors les récupérer.
La formule générale des acides aminés naturels (figure n°1) montre que l’atome de carbone en α est un
atome de carbone asymétrique c'est-à-dire qu’il est un centre de chiralité. Sa
configuration absolue correspond à la forme S selon la définition de Cahn
Ingold Prelog. D’après la classification donnée par Emil Fischer on a qualifié
cette forme de L. Le seul aminoacide n’ayant pas de centre d’asymétrie et qui
est le plus simple est la glycine (car R=H).
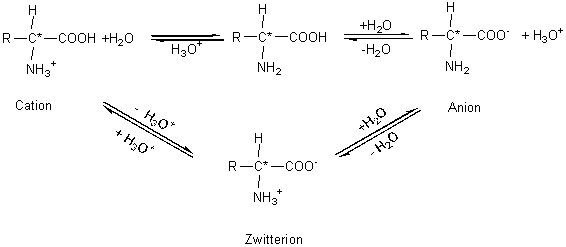
Les aminoacides contiennent dans la même molécule, à la fois
un groupe amine et un groupe carboxyle :
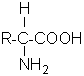
Le groupe amine peut en tant qu’accepteur de protons donner
un cation, tandis que le groupement carboxyle en tant que donneur de protons
peut quant à lui donner un anion. La forme de l’ionisation dépend du pH de la
solution. A un certain pH, la molécule pourra être à la fois et également un
anion et un cation. On appelle ce point le point isoélectrique, tandis qu’on
appelle la molécule doublement chargée : zwitterion. C’est à ce point que la
solubilité des acides aminés est la plus faible, le pKs a 2,5 unités
de plus que celui de l’acide acétique. A l’état solide les acides aminés se
présentent comme des zwitterions. Comme on peut s’y attendre dans le cas des
composés ioniques, les points de fusion sont élevés et s’accompagnent d’une
décomposition. Dans les solutions aqueuses on ne rencontre presque jamais de
forme non dissociée.
Différents
aminoacides
Tous portent des noms communs qui sont souvent liés soit à
la manière dont ils ont été isolés soit à leurs propriétés.
La bétaïne
(tableau 4 n° 23) est un cas particulier. Elle se
présente clairement comme un zwitterion.
C’est pourquoi les zwitterions sont également qualifiés de bétaïnes. La bétaïne
ne peut d’après sa structure que constituer le groupe final d’un polypeptide.
Elle doit à sa présence dans la mélasse (du latin mel : miel) un sirop
de sucre foncé que l’on trouve lors de l’extraction du sucre de la betterave (Andreas
Marggraf 1709-1782),
son nom de bétaïne (du latin : beta, la betterave). La bétaïne apporte
les groupes méthyle lors du processus de transméthylation.
Le premier acide aminé a été isolé dans le jus des asperges (du latin asparagus) en 1806 par Vauquelin et Robiquet et nommé asparagine (tableau1B n° 14). Ce n’est pourtant qu’en 1968 que Ritthausen a découvert dans le germes de légumineuses l’acide aspartique (tableau 3 n°19). L’acide aspartique joue de même que l’acide glutamique un rôle important d’élimination lorsqu’ apparait dans le métabolisme des acides aminés, l’ammoniaque due à l’urée ou au cycle ornithique.
La glycine (tableau 1B n° 9) que l’on a longtemps encore appelé glycocolle (ce qui signifie colle sucrée, du grec glykos, doux et kolla, la colle)est l’exemple typique d’un acide aminé obtenu par hydrolysat. Pour produire la colle on faisait bouillir des déchets animaux tels que la peau, les oreilles, les cartilages, les tendons. C’est de la même manière que l’on obtient la gélatine. C’est à partir de tels hydrolysats que Braconnot a isolé en 1820 la glycine.
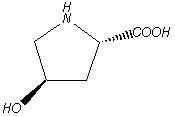
C’est à partir de l’hydrolysat de cheveux que W.C.Rose a isolé en 1935 la thréonine (tableau 1B n°11). Ce nom vient de ce que les deux carbones asymétriques présentent une configuration semblable à celle de la thréose dans le sucre. L’oxydation de cette dernière donne de l’acide tartrique ; tandis que le sucre énantiomère érythrose s’oxyde en acide méso-tartrique.
En 1865 Cramer a
isolé à partir de la " colle " de soie la sérine (du latin sericus,de
soie)(tableau 1B n° 10) un autre acide aminé
présentant un groupement alcool OH.
En 1846 Liebig
a fait subir a du fromage une fusion alcaline et a obtenu un acide aminé qu’il
a baptisé tyrosine (tableau 1B n°13) (du grec tyros, le fromage).
L’arginine
(tableau 2 n° 17) est connu depuis 1886 et doit son nom
à un sel d’argent difficilement soluble (du latin argentum : argent).
En 1866 on a isolé de façon concomitante, la glutamine (tableau
1B n° 15) et l’acide glutamique
(tableau 3 n°20) à partir du gluten (du latin gluten
: colle) présent dans le blé.
La lysine
(du grec lysis, coupure) (tableau 2 n° 16) a été
obtenue pour la première fois par Drechsel en 1899 à partir de la caséïne (du
latin caseus, fromage).
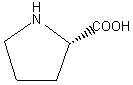
On trouve la proline
(tableau 1A n° 5) de même que l’hydroxyproline (tableau 4 n° 22) dans de nombreux hydrolysats de
protéïnes. Elle a été isolée en 1901 par Emil Fischer.
La leucine
(tableau 1A n°3) tire son nom de cristaux en écailles
blancs et scintillants (du grec leukos, blanc). Proust l’a isolée en
1819.
L’isoleucine
(du grec isos, identique, même, égal) (tableau 1A
n°4) a été découverte par Ehrlich en 1904 dans la mélasse.
La leucine et l’isoleucine, associées aux protéines du jus
de raisin et des céréales ou des pommes de terre présentes dans les solutions
destinées à la fermentation, se transforment lors d’une fermentation alcoolique
en alcool isoamylique (3-méthylbutanol et
2-méthylbutanol). Amylique, parce qu'on pensait que l'amidon (en grec amylon)
en était à l'origine. Lors de la distillation, ces deux alcools se concentrent
et deviennent du " fuselöl " (du latin fusilis, liquide,
fondu).
A partir de deux molécules de cystéine (tableau
1B n° 12) se forme, par oxydation, de la cystine caractérisée par une
liaison S-S. C’est par de tels ponts S-S que peuvent se maintenir en place des
chaînes de peptides. Les liaisons hydrogène entre les différentes chaînes de
peptides sont, elles, plus lâches. Ces groupes de scléroprotéines (du grec skleros,
dur) qui appartiennent aussi aux tissus liants sont en outre caractérisés par
une structure particulière.
Par réduction de la cystine obtenue par hydrolyse, on obtient
de la cystéine qui peut être aisément réoxydée. Dans le cas de la "
permanente " également, les liaisons S-S sont tout d’abord réduites puis
réoxydées et c’est ainsi que l’on fixe la forme souhaitée (vague, plis).
La cystine est difficilement soluble et résiste à la
digestion. Il n’y a qu’une mite particulière, la mite vestimentaire, qui
possède une enzyme lui permettant de se nourrir de laine. Le glutathion qui a
une action anti-oxydante est un tripeptide composé de cystéine, de glutamine et
de glycine : γ-Glu-Cys-Gly (figure n°3). On remarque
dans ce cas que le lien se fait par le groupe γ-carboxyle plutôt que par
le groupe α-carboxyle ce qui est peu commun.
Dans l’espoir de découvrir de nouveaux acides aminés on s’est livré à l’hydrolyse de protéines rares. C’est ainsi que Kossel a découvert l’histidine (tableau 2 n° 18) en 1886 dans la sturamine qui est une protamine issue du sperme d’esturgeon. A partir de ces acides aminés présents également dans l’hémoglobine on obtient, par décarboxylation, de l’histamine (du grec histos, tissus) qui déclenche les symptômes de l’allergie.
La méthionine (tableau
1B n° 8), elle aussi anti-oxydante, n’a été découverte qu’en 1921. C’est un
capteur efficace de radicaux libres dans l’organisme. La méthionine apporte les
groupes méthyle lors du processus de transméthylation. La méthionine est aussi
la forme première de l’hormone de maturation " éthène des pommes ".
L’oligo-élément sélénium occupe dans la sélénométhionine la place du soufre
dans la méthionine.
La phénylalanine
(tableau 1A n° 6) forme avec la tyrosine et le tryptophane (tableau
1A n° 7) le groupe des acides aminés aromatiques qui sont à l’origine de la
réaction xanthoprotéique (du grec xanthos, jaune) c'est-à-dire de la coloration
jaune que prend la peau au contact d’acide nitrique concentré. Dans
l’organisme, la phénylalanine est par hydroxylation oxydative, transformée en
tyrosine. La transformation se poursuit en passant par la dopa
(dihydroxyphénylalanine) et la dopamine
pour donner les hormones surrénales : la noradrénaline et l’adrénaline. La dopa est également
la forme première du pigment (du latin pigmentum, teinte) de la mélanine
(du grec melas, noir). L’hormone hypophysaire mélatonine et l’hormone placée dans
les tissus, la sérotonine, sont formées à partir du tryptophane.
Digestion
et métabolisme
La digestion est le résultat du travail de l’estomac et de
l’intestin et a pour but le recyclage des éléments par l’organisme. Le
métabolisme (du grec metabole, transformation) consiste en l’étude de la
transformation des substances absorbées ou plutôt résorbées (du latin resorbere,
retenues) dans l’organisme.
Les protéines peuvent être directement résorbées ; il leur faut d’abord être digérées. Les enzymes digestifs (du grec en, dans et zumê, levain) comme par exemple la pepsine (du grec pepsis, digestion) et la trypsine sont connues depuis longtemps. Ces enzymes agissent à différents niveaux de pH : la pepsine est une endopeptidase qui fragmente la chaîne de peptides présente dans l’estomac et ce au contact de phénylalanine ou de tyrosine. Dans l’intestin grêle certains acides aminés qui constituent le maillon terminal des chaînes de peptides sont donc séparés de ces chaînes par des exopeptidases (trypsine et chymotrypsine) et peuvent alors être résorbées.
Parallèlement à l’hydroxylation évoquée dans le cas de la phénylalanine, la désamination oxydative est une réaction générale et importante. Les acides α-cétoniques rentrent après d’éventuelles transformations dans le cycle de l’acide citrique. Inversement, des acides α-cétoniques peuvent résulter de la transamination réductive des acides aminés.
Lorsque le chemin qui mène de la phénylalanine à la tyrosine est bloqué par l’absence du système enzymatique, alors l' acide phénylpyruvique (acide α-cétophénylpropionique ou 2-oxophénylpropanoïque) s'enrichit. Cette maladie héréditaire s’appelle la phénylcétonurie (du latin urina et du grec uron, l’urine) et entraîne des lésions cérébrales irréversibles. Le diagnostique (du grec diagnosis, jugement, avis) doit être établi le plus tôt possible chez le nouveau-né, la thérapie consiste en un régime pauvre en phénylalanine.
Les
aminoacides essentiels
Tous les aminoacides ne peuvent pas se former dans
l’organisme humain. Ceux qui sont dans ce cas doivent lui être fournis.
Les recherches nutritionnelles basées sur des régimes qui permettent l’apport à l’organisme de ces substances sont dues à W.C.Rose(1937) qui a découvert avec la thréonine le premier acide aminé essentiel (du latin essentia, être) c'est-à-dire indispensable.
Comme ces recherches n’aboutissent pas toujours à des résultats clairs (univoques) parce qu’il arrive que l’organisme parvienne à produire un acide aminé mais en quantité insuffisante, on parle également des acides aminés semi-essentiels comme par exemple l’arginine et l’histidine.
Dans le tableau n° 5 sont regroupés les huit acides aminés essentiels (vitaux pour l'homme). Pour le rat l’histidine est elle aussi essentielle ; les plantes et les microorganismes peuvent quant à eux synthétiser tous les acides aminés.
|
|
|
|
|
b) Dipeptide |
|
|
Formule générale![]()
|
Aminoacides non polaires et hydrophobes |
|||||||||||||||||||||||||||
* Essentiel pour l'homme |
|
Aminoacides à chaîne latérale polaire |
||||||||||||||||||||||||
* Essentiel pour l'homme |
TABLEAU
2
Aminoacides basiques
* Essentiel pour l'homme |
|
|
TABLEAU
5
Aminoacides essentiels
|
ISOLEUCINE |
Traduction: Anne-Sophie GOMEZ
Document original en allemand.