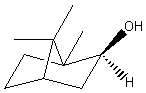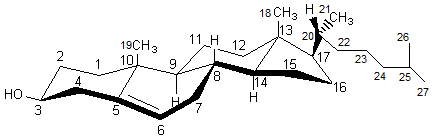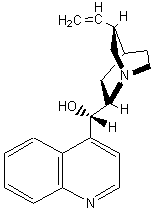MEDICAMENTS ET MOLECULES PARTICULIERES
|
Nom |
Formule |
Propriétés ou provenance |
||||||
|
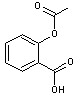
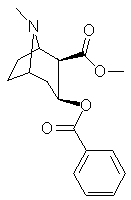
Aspirine(ou
|
C’est John Vane (Prix Nobel de médecine en 1982) qui découvre le
rôle des prostaglandines dans les phénomènes inflammatoires. Elle a été préparée à l'état pur
et stable en 1899 par Félix Hoffmann chimiste de Bayer à Elberfeld. C'est un acide de synthèse
réalisé sans recours à la spirée (spiraea) plante
qui le contient spontanément d'où son nom : "a" privatif et le
reste du nom rappelant le nom de la plante. |
|||||||
|
Paracétamol ou N-(4-hydroxyphényl)-acétamide ou acétaminophène |
Antipyrétique et analgésique(il fait
baisser la fièvre),principe actif du Dafalgan®, du
Doliprane®, notamment, concurrent de l'aspirine, mais avec
moins d'effets secondaires. |
|||||||
|
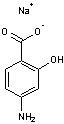
PAS Caractéristiques de l'acide 4-aminosalicylique
(ou acide 4-amino-2-hydroxybenzoïque) |
|
Antibiotique utilisé pour lutter contre la tuberculose. |
||||||
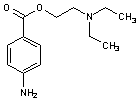
|
ORL (anesthésique local,vasodilatateur). |
||||||||
|
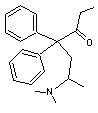
Méthadone C21H27NO
|
Analgésique central aux propriétés voisines de celles de la morphine. Cette molécule est utilisée dans la
désintoxication des toxicomanes. |
|||||||
|
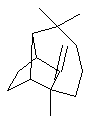
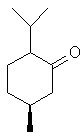
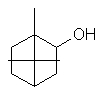
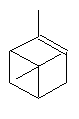
Camphre (+/-) ou 1,7,7-triméthylbicyclo[2,2,1]heptan-2-one C10H16O Masse
molaire : Ebullition : Se
sublime Densité: 0,99420 Indice de réfraction: 1,427878 N° CAS :
Solubilité : Très
soluble dans l'éthanol et l'éther ; soluble dans l'acétone et le benzène ;
insoluble dans l'eau. Camphre
(+) ou (1R)1,7,7-triméthylbicyclo[2,2,1]heptan-2-one C10H16O Masse
molaire : Ebullition : 207,4°C Densité : 0,990 à
25°C Indice de
réfraction : 1,5462 N° CAS :
Solubilité : Très
soluble dans l'éthanol et l'éther ; soluble dans l'acétone et le benzène ;
insoluble dans l'eau. |
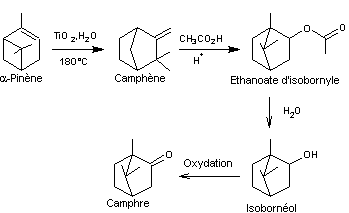
Une
synthèse industrielle du camphre à partir de l'α-pinène :
Biosynthèse
du camphre à partir du diphosphate de géranyle (GPP) :
|
C'est un terpène oxygéné, extrait du camphrier (Cinnamomum camphora), arbre de la famille des lauracées, à feuilles persistantes qui pousse bien en Asie tropicale où il porte le nom Kapuru-gaha. La distillation des copeaux de la tige, ou des racines produit l'huile de camphre, analgésique et antiseptique. On l'utilise aussi pour activer la circulation (frictions de la poitrine et des muscles). C'est
Julius Bredt (1885-1937) qui proposa en 1893 une
formule constituée de deux cycles "en pont". Citons aussi Otto Wallach (1847-1931)
Prix Nobel de chimie en 1910 qui a particulièrement fait progresser la chimie
du camphre et des terpènes. 1903
: Synthèse partielle par Albin Haller (1849-1925), Professeur à la Sorbonne. 1948
Synthèse, par Niilo Toivonen
(né en 1888) Professeur à Helsinki, sur le modèle des synthèses de l'acide
camphorique et de l'α-pinène qui avaient été
menées en 1903 par Gustav Komppa (1867-1949)
Professeur à Helsinki. Composant
de la balistite un explosif breveté par Alfred Nobel en 1887 et qui est
composé de 10% camphre 45% de nitroglycérine et 45% de collodion, le camphre jouant
le rôle de stabilisant. On a
utilisé le camphre dans la synthèse de la corrine,
molécule complexant le Cobalt dans la vitamine B12.
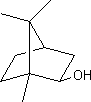
ou (1S)1,7,7-triméthylbicyclo[2,2,1]heptan-2-one C10H16O Masse
molaire : Densité : 0,9853
à 18°C N°
CAS : Solubilité : Très
soluble dans l'éthanol, l'éther et l'acide acétique;
soluble dans l'acétone et le benzène ; insoluble dans l'eau. |
||||||
|
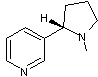
L-Nicotine ou
(S)-3-(1-méthyl-2-pyrrolidinyl)pyridine C10H14N2 Aspect : Liquide huileux,
hygroscopique, brunissant à la lumière. |
Alcaloïde présent dans
les feuilles de tabac (2 à 8 % dans les feuilles séchées). Cette molécule a été découverte
en 1809 par Louis-Nicolas
Vauquelin. Aimé Pictet
(Professeur à Genève) joua un rôle décisif dans sa synthèse en
1904. C’est un agoniste du récepteur de
l’acétylcholine (c'est-à-dire qu’il se fixe sur le même récepteur des
cellules que l’acétylcholine et produit sur ces cellules les mêmes effets (du
moins en partie)). Stimulant à faible dose, il
provoque nausées et vomissements à forte dose ; la dose létale se
situerait entre 50 et 60 mg environ pour les humains. |
|||||||
|
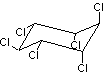
Lindane ou γ
1,2,3,4,5,6-Hexachlorocyclohexane ou γ-HCH C6H6Cl6 Masse molaire Ebullition 323°C Solubilité Eau à 25°C : 8mg/L N° CAS 58-89-9 |
Insecticide organochloré qui a
été longtemps utilisé en agriculture. Interdit aujourd'hui en France et
dans de nombreux pays car c'est un neurotoxique pour l'homme ainsi qu'un
agent cancérigène et un perturbateur endocrinien. |
|||||||
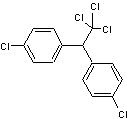
|
DDT C14H9Cl5 Masse
molaire : Ebullition : 260°C 186°C (à
0,05mm de Hg) N° CAS :
|
Insecticide organochloré : |
|||||||
|
Carbaryl |
Insecticide |
|||||||
|
Cocaïne Aspect : Poudre
blanche floconneuse. |
Alcaloïde
extrait des feuilles de coca ; anesthésique local et stimulant du système
nerveux central. Son usage prolongé conduit à une grave toxicomanie. |
|||||||
|
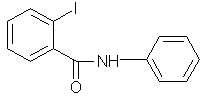
Bénodanil |
Fongicide |
|||||||
|
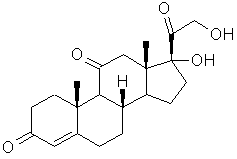
Cortisone |
Stéroïde ; hormone produite par
les glandes corticosurrénales. Extraite en 1935 par Edward
Calvin Kendall de la glande cortico-surrénale des ruminants. |
|||||||
|
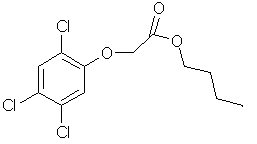
2,4,5,T
(RUBOX) |
Herbicide sélectif, |
|||||||
|
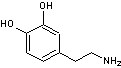
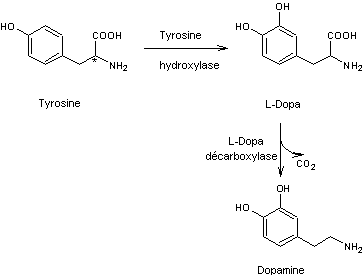
Dopamine |
Molécule formée par décarboxylation enzymatique de la dopa, elle-même dérivant de la tyrosine par hydroxylation.
La dopamine est un neurotransmetteur synthétisé dans les neurones pré-synaptiques. Elle est stockée dans les vésicules synaptiques au niveau de la terminaison nerveuse. À l’arrivée d’un potentiel d’action, la dopamine est libérée dans la fente synaptique. Elle peut alors se fixer sur des récepteurs spécifiques des neurones post-synaptiques. Les neurones dopaminergiques synthétisent et libèrent de la
dopamine au niveau des synapses. La perte de ces neurones entraîne une
diminution de la libération de la dopamine dans le striatum qui intervient
dans le contrôle des mouvements, entrainant l’apparition des symptômes. |
C'est une catécholamine (présence de 2 groupements OH
phénoliques en ortho comme dans le pyrocatéchol).C'est un
neurotransmetteur (messager chimique entre les neurones) jouant un rôle
important dans le fonctionnement du cerveau. Le manque de dopamine dans le
système nerveux central provoque la maladie de Parkinson. |
||||||
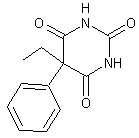
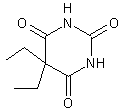
|
Gardénal Phénobarbital ou luminal ou ou 5-éthyl-5-phényl-2,4,6(1H, 3H, 5H)pyrimidinetrione. Masse
molaire : N° CAS :
Solubilité : Soluble
dans l'éthanol et l'éther ; légèrement soluble dans le DMSO. |
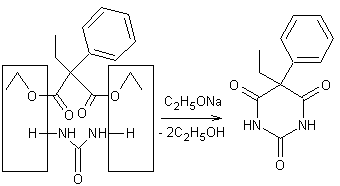
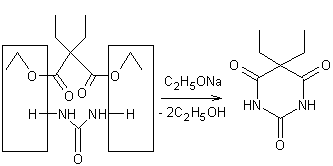
peut
l'obtenir par condensation avec l'urée du dimalonate
d'éthyle éthylé et phénylé
sur le carbone :
|
C'est un
barbiturique. On
appelle barbituriques, des dérivés dialcoylés ou
arylés au carbone de l'acide
barbiturique. Ils ont été utilisés comme calmants somnifères et
hypnotiques. Le
gardénal a été préparé en 1912 par Heinrich Hörlein
(1882-1954 ; élève de Knorr
; chimiste à l'usine Bayer de Leverkusen). Il a une action particulièrement
prolongée. |
||||||
|
Véronal Barbital ou ou Acide
5,5-diéthylbarbiturique Masse
molaire : Densité : 1,220 (à
25°C) N° CAS :
Solubilité : Soluble dans l'éthanol, l'éther, l'acétone, le chloroforme ; légèrement soluble dans l'eau. |
On
peut l'obtenir par condensation avec l'urée du dimalonate
d'éthyle diéthylé sur le carbone :
|
C'est un
barbiturique. On
appelle barbituriques, des dérivés dialcoylés ou arylés
au carbone de l'acide barbiturique.
Ils ont été utilisés comme calmants somnifères et hypnotiques. Le
véronal a été le premier barbiturique à être élaboré ; c'est Emil Fischer en
collaboration avec le médecin Joseph von Mering
(1849-1908) (Professeur à Halle) qui le synthétisa pour la première fois en
1903. |
||||||
|
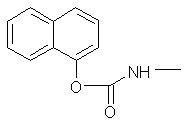
Propoxur |
Insecticide |
|||||||
|
Vanille(composé
naturel) |
Parfum alimentaire que l’on peut extraire du
fruit du vanillier. La pollinisation de la fleur de vanille est impossible sans
intervention extérieure. Il existe en effet une fine languette qui empêche le
contact entre étamines et pistil donc la fécondation. Les photographies ci-contre montrent respectivement la fleur du
vanillier et comment l’homme assure manuellement sa fécondation à la Réunion. |
|||||||
|
Longifolène |
Odeur de l'essence de térébenthine. |
|||||||
|
Irone |
Odeur de violette ; présent dans l'iris. |
|||||||
|
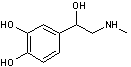
Adrénaline
C9H13NO3
|
Catécholamine. Les
glandes surrénales, glandes endocrines, sont des masses de 5 à 7 g d'un gris
jaunâtre, placées au dessus des reins ; elles sont
constituées de deux substances, l'une périphérique, la substance corticale ;
l'autre centrale, la substance médullaire. |
|||||||
|
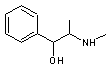
Ephédrine |
Contenue dans la tige de l'Ephedra
sinica. |
|||||||
|
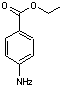
Benzocaïne
® |
La benzocaïne est utilisée comme anesthésique local d’usage externe; elle est un composant actif des crèmes pour le traitement des coups de soleil. |
|||||||
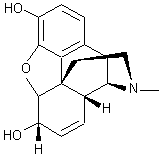
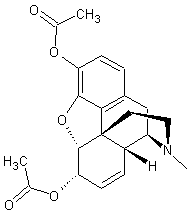
|
Morphine
|
Ce nom vient de Morphée, Dieu des songes, fils de la nuit et du
sommeil. Pavot à opium : papaver somniferum. Les graines sont ajoutées aux pains, gâteaux
et mélanges pour oiseaux. Le latex des capsules non mûres donne l’opium. Opium officinal : Titre 10% de
morphine. Il doit ses propriétés à un grand nombre d’alcaloïdes. |
|||||||
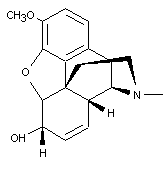
|
Codéine |
Alcaloïde
de l'opium, antalgique et sédatif.
|
|||||||
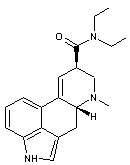
|
LSD (Lyserg Saüre Diethylamid) ou Lysergide C20H25N3O Masse
molaire : 323,432g.mol-1
50-37-3 |
Diéthylamide de l'acide lysergique
|
|||||||
|
Menthol |
La menthe poivrée (mentha piperita) |
Un des constituants de l'essence de menthe. |
||||||
|
Menthone |
Un des constituants de l'essence de menthe. Elle peut aussi être obtenue par oxydation en milieu acide du menthol. |
|||||||
|
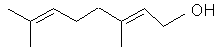
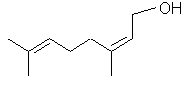
Géraniol |
Contribue à donner son odeur à la rose. |
|||||||
|
Nérol |
Contribue à donner son odeur à la rose. |
|||||||
|
Isobornéol (dl)
|
Contribue à donner son odeur au pin. |
|||||||
|
Terpinéol |
Participe à l'odeur des lilas. |
|||||||
|
Citronellal |
Participe à l'odeur de la citronnelle .
|
|||||||
|
Linalol C10H18O
|
Muguet - Convallaria majalis –
Jardin botanique de Belgique |
Terpène isolé de l'essence de
cannelle, de sassafras, de fleur d'oranger et de muguet. |
||||||
|
Myrcénol |
Citron |
|||||||
|
Limonène |
Essence
de citron (terpène) Le
limonène se forme également (9%) par déshydratation de
l'α-terpinéol. |
|||||||
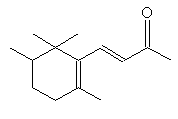
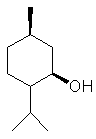
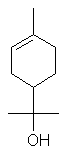
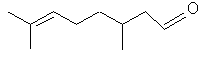
|
a-pinène
2-pinène ou Aspect : liquide Fusion :
156,2°C Densité
: 0,8539
(à 25°C) Indice
de réfraction : 1,4632
(à 25°C) Solubilité : Miscible
à l'éthanol, l'éther, le chloroforme ; insoluble dans l'eau. |
terpène Matière
première dans une synthèse du camphre. |
|||||||
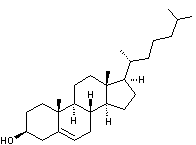
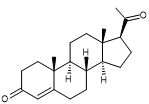
|
Cholestérol Masse molaire : Huit carbones asymétriques soit 256 stéréoisomères dont un seul
existe dans la nature. |
|
C’est un des stéroïdes les plus répandus que l’on retrouve en
assez grande quantité tant chez les animaux que chez les humains (200 à 300 g
chez un humain adulte). Produit
par le foie. Synthèse totale par Robinson . C'est un
constituant important des membranes biologiques ; il participe à la
régulation de leur viscosité et augmente leur imperméabilité vis-à-vis des
molécules hydrophiles. C'est aussi un précurseur des hormones stéroidiennes, des acides biliaires et de certaines
vitamines (D par exemple).
Les
laboratoires d'analyses médicales indiquent comme valeurs normales pour le
cholestérol total , le HDL
et le LDL : CHOLESTEROL TOTAL: 1,50 à 2,60 g/L
La biosynthèse du cholestérol à partir de l’acide acétique passe par le géranylpyrophosphate, le farnésylpyrophosphate, le squalène, le lanostérol. |
||||||
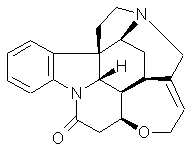
|
(-)Strychnine |
Poison violent. C'est une base utilisée pour la résolution des inverses
optiques à partir du racémique d'un
acide. |
|||||||
|
C20H24N2O2 |
|
Molécule (alcaloïde) extraite de la
poudre d'écorce du quinquina rouge, plante de la famille des rubiacées,
vivant dans la cordillère des Andes à des altitudes d'environ 2000m et
actuellement cultivée en Asie. C'est un agent antimalarique (antipaludéen). C'est également une base utilisée pour la résolution des inverses
optiques à partir du racémique d'un
acide. Elle est utilisée comme agent d’amertume dans certaines boissons (« tonics »). |
||||||
|
Héroïne ou Diacétylmorphine C21H23NO5 Masse molaire :
Densité : 1,56 (à 25°C) |
Opioïde dérivé d’un alcaloïde : la
morphine. C’est une drogue entraînant une dépendance physiologique et
psychologique. |
|||||||
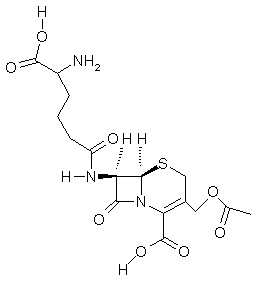
|
Céphalosporine C |
Antibiotique. Les céphalosporines sont des β-lactames s’apparentant aux pénicillines. Elles sont actives vis-à-vis des
germes résistant à celles-ci. L’activité des céphalosporines et des pénicillines s’explique
par la présence d’un cycle β-lactame qui est tendu (quatre carbones) et
ne demande qu’à s’ouvrir ; il se révèle beaucoup plus réactif qu’un
simple amide. Les céphalosporines contrairement aux pénicillines résistent aux
pénicillinases, enzymes secrétés
par des bactéries, qui permettent l’hydrolyse du β-lactame avant que la
molécule n’ait eu le temps de « s’accrocher » au transpeptidase et qu’elle n’ait
eu donc le temps de le neutraliser. Rappelons que le transpeptidase est nécessaire à
la biosynthèse de la membrane cellulaire des bactéries. |
|||||||
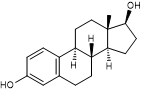
|
Estradiol
|
Stéroïde; hormone oestrogène (sexuelle féminine)
qui règle avec l'oestrone
ou folliculine, le cycle menstruel. |
|||||||
|
Stéroïde; Hormone sexuelle masculine produite dans les testicules. Contribue à l'apparition et au maintien des caractères sexuels. |
||||||||
|
Progestérone C21H30O2 Solubilité : Soluble dans l’acétone, le dioxanne, l’éthanol. Insoluble dans l’eau. |
Stéroïde; Hormone de grossesse produite
par l'ovaire. Elle favorise l'implantation du zygote et le maintien de la
grossesse. La progestérone est synthétisée essentiellement par l'ovaire et,
à un moindre degré, par le testicule, les glandes surrénales et le placenta
au cours de la deuxième partie de la grossesse. De plus, une synthèse non
endocrine de progestérone, au niveau des neurones notamment, est possible. La
synthèse se fait à partir du cholestérol : sous l'influence d'une
desmolase, le cholestérol est transformé en prégnénolone qui, sous
l'influence d'une déshydrogénase et d'une isomérase, donne la progestérone. |
|||||||
|
Vitamine A |
Synthèse :
|
Importante molécule intervenant indirectement dans le
mécanisme |
||||||
|
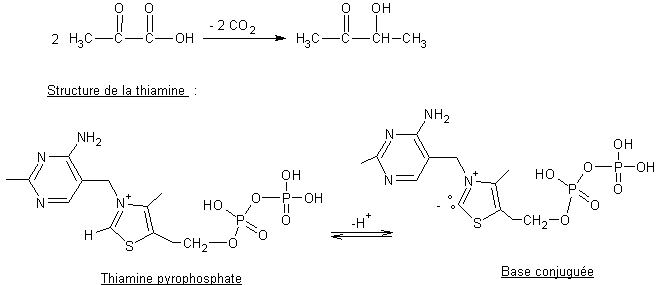
Vitamine B1 |
Chlorure de thiamine
|
C’est la
première vitamine qui a été découverte ; Christiaan Eijkmann
(élève de Robert Koch qui a reçu le Prix Nobel de médecine pour ses
recherches sur la tuberculose) l’a trouvée en 1897 dans la cuticule du riz et
le germe de céréales. Son
pyrophosphate est un coenzyme de la décarboxylation oxydative du pyruvate ou
de l’α-cétoglutarate dans les complexes enzymatiques
pyruvate-déshydrogénase ou cétoglutarate-déshydrogénase. |
||||||
|
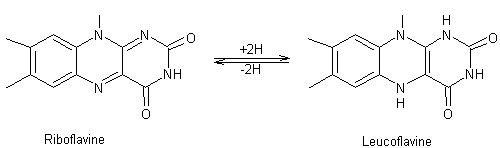
Vitamine B2 |
Par action de la riboflavinase (enzyme) la riboflavine donne avec l'eau du
ribitol et du lumichrome :
|
La riboflavine est légèrement soluble dans l’eau et à un pH compris
entre 3 et 9 sa solution est jaune vert (jaune fluorescent). Par réduction
cette solution devient incolore, la riboflavine ayant été transformée en leucoflavine. Si l’on agite cette solution à l’air elle
retrouve sa couleur fluorescente. Les flavines sont des coenzymes qui transportent deux protons et
deux électrons. C’est par un mécanisme faisant intervenir hydrogène ou
électron qu’elles interviennent dans les oxydations cellulaires en se
réduisant et se réoxydant réversiblement. C'est une vitamine essentielle à la croissance et au
développement des cellules. Sa concentration dans le sang doit être contrôlée
car la majeure partie de cette vitamine est excrétée dans l'urine. Cette molécule ne peut pas être synthétisée dans le corps
humain. Elle doit donc provenir de sources alimentaires. Apports : Céréales complètes, viande, poisson, lait
et oeufs, légumes (épinards, endives), thé, vin. Carence : inflammation des lèvres et
de la cornée (kératite) avec diminution de l’acuité visuelle. Pour quantifier la concentration en riboflavine, il est possible
d'utiliser la (-)-quinine. La riboflavine conduit à
une inhibition de la fluorescence de la (-)-quinine
(diminution d'intensité de cette fluorescence). |
||||||
|
Vitamine B6 |
Groupe prosthétique de diverses enzymes. Carence : Acrodynie (maladie touchant les
extrémités (mains, pieds, nez) qui sont tuméfiées, douloureuses, cyanosées et
s’accompagnant de troubles nerveux et circulatoires). |
|||||||
|
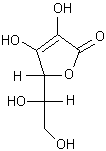
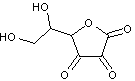
Vitamine
C C'est la lactone de l'acide 2,3,4,5,6 pentahydroxyhex-2-ènoïque.
|
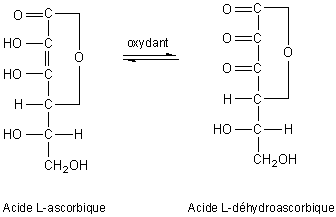
Possède des propriétés réductrices :
Les groupements énoliques sont
facilement oxydés (E0 = 0,166V à pH =4 et q = 35°C)
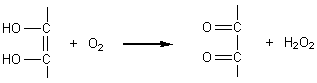
en face d'un accepteur d'hydrogène. Rôle biochimique : transferts d'hydrogène (réduction du tocophérol, dégradation de la tyrosine, réduction de l'acide folique en acide tétrahydrofolique). L'acide L-ascorbique se forme dans l'organisme animal à partir de l'acide glucuronique par l'intermédiaire de l'acide L-gulonique et de la g-lactone de l'acide gulonique. |
Additif alimentaire: E300
|
||||||
|
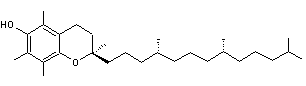
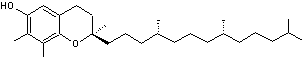
Vitamine E C'est
un mélange de substances de structures voisines parmi lesquelles les
tocophérols a, b, g, d. |
Alpha-tocophérol (a-tocophérol)
|