ACTION DES STEREO-ISOMERES SUR LA LUMIERE POLARISEE
Rappelons que l’activité optique d’une
substance est caractérisée par son pouvoir rotatoire spécifique [α]θ
λ et que l’angle
de rotation du plan de polarisation régi par la loi de Biot : α =
[α]θ λ .l.c
Avec :
L : longueur de substance traversée en
dm ;
c : concentration
de la solution en g.cm-3 ;
α : angle de
rotation exprimé en degrés ;
[α]θ λ :
pouvoir rotatoire spécifique en °.dm-1.g-1.cm3.
Θ : est la température ;
λ :
est la longueur
d’onde de la lumière utilisée (souvent la raie D du sodium).
1) Un seul carbone
asymétrique dans la molécule:
Un des isomère est d (dextrogyre) l'autre est l (lévogyre). Ils font tous les
deux tourner le plan de polarisation de la lumière d'un même angle, mais
le dextrogyre vers la droite (+ a)
l'autre vers la gauche (- a).
Ces deux isomères sont des énantiomères.
Un mélange équimolaire de ces isomères est inactif sur la lumière
polarisée: c'est un mélange racémique.
2) Deux carbones asymétriques dans la molécule:
1er Exemple: le 2,3,4-trihydroxybutanal HOCH2-C*HOH-C*HOH-CH=O
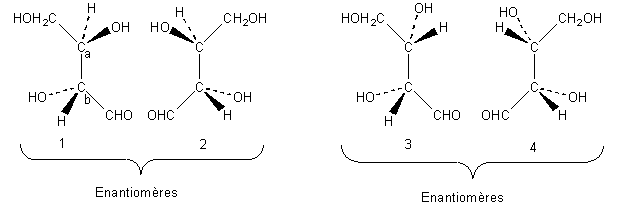
1 et 2 feront
tourner le plan de polarisation d'un angle a , l'un
vers la droite (d) l'autre vers la gauche (l). Ce sont des énantiomères. Un
mélange équimolaire de ces isomères est un racémique.
3 et 4 feront
tourner le plan de polarisation d'un angle a' , l'un vers la droite (d) l'autre vers
la gauche (l). Ce sont des énantiomères. Un mélange équimolaire de ces isomères
est un racémique.
1 et 3 sont des
diastéréoisomères, ils seront actifs sur la lumière polarisée, mais l'un fera
tourner le plan de polarisation de a (1)
et l'autre de a' (3) et de même pour
1 et 4, 2 et 3, 2 et 4.
On voit que des
diastéréoisomères peuvent faire tourner le plan de polarisation de la lumière dans
le même sens ou en sens contraire suivant le couple auquel on s'adresse.
Exercice: vous attribuerez aux
carbones a et b des 4 molécules ci-dessus les configurations
absolues R ou S.
2ème exemple: le 2,3-dichlorobutane:CH3-C*HCl-C*HCl-CH3 .On remarque que les deux carbones asymétriques portent les mêmes substituants.
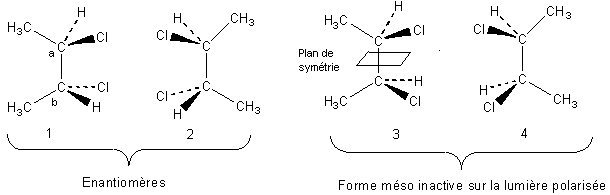
Les
isomères 1 et 2 sont des énantiomères; un mélange équimolaire est inactif sur
la lumière polarisée, c'est un racémique.
Les isomères 3 et 4 par contre correspondent à la même molécule; il suffit simplement de retourner l'une d'entre elles pour la faire coïncider avec l'autre. Cette molécule possède un plan de symétrie….elle n'est pas active sur la lumière polarisée….On dit que l'on a la forme méso. 1 et 3 ainsi que 2 et 3 continuent à être des diastéréoisomères.
Exercice: vous attribuerez aux carbones a et b des 4 molécules ci-dessus les configurations absolues R ou S.
3)
Composés érythro et thréo :
On considère
les deux oses suivants:
(-)
érythrose
:configuration 2R,3R
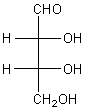
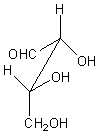
Par
oxydationpar l'acide nitrique il donne l'acide mésotartrique (il y a un plan de
symétrie à l'intérieur de la molécule):
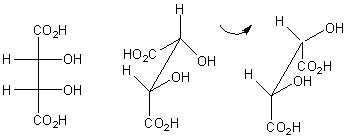
(+)thréose :configuration 2R,3S
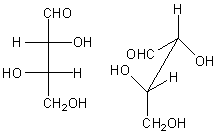
Par oxydation par
l'acide nitrique il donne l'acide (+)tartrique (il n'y a pas de plan de
symétrie à l'intérieur de la molécule):
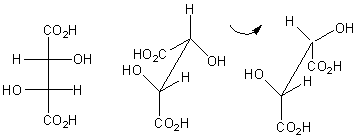
Par analogie
avec ces deux oses, on a décidé, pour distinguer des composés
diastéréoisomères ayant deux carbones adjacents asymétriques et
dissemblables, d'utiliser les préfixes érythro et thréo.
Par exemple :
érythro-2-bromo-3-phénylbutane
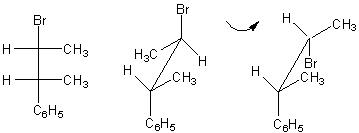 ou en représentation de Newman
ou en représentation de Newman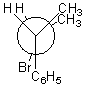
L'énantiomère
de cette molécule qui est ausi un érythro-2-bromo-3-phénylbutane
se représente:
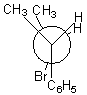
thréo-2-bromo-3-phénylbutane
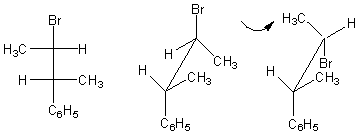 ou en représentation de Newman
ou en représentation de Newman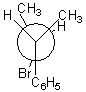
L'énantiomère
de cette molécule qui est ausi un thréo-2-bromo-3-phénylbutane
se représente:
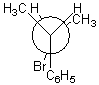
Si par exemple
on change dans le composé érythro, -Br par -C6H5 (ou le contraire) on
s'aperçoit que l'on obtient un composé méso (comme avec
l'érythrose par oxydation), car la molécule posséde alors un plan de symétrie ;
ce n'est pas le cas avec le composé thréo .