LES STEROÏDES
(Rudiments)
1) Définition
- structure:
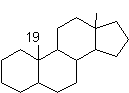
On désigne généralement par
stéroïde, un composé comportant le squelette carboné du stérane (cyclopentanophénanthrène hydrogéné) :
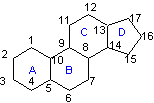
Cela revient à dire que l'on trouve
3 cycles de type cyclohexane accolés comme dans le phénantrène, et généralement
de manière trans (A,B,C), et un cyclopentane (D).
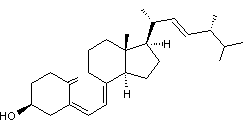
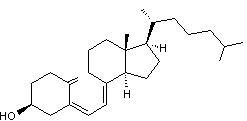
Exemple: le cholestérol
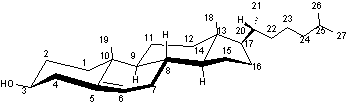
L'articulation des cycles montre
qu'on peut considérer un plan moyen pour la structure de la molécule de
cholestérol (il en sera de même, en principe, pour les autres stéroïdes). Par
convention, la molécule est vue le méthyle CH3 en18 lié à C13 et le
méthyle CH3 en19 lié à C 10 placés au dessus du plan.
Un substituant situé au dessus du
plan est dit orienté en β et indiqué par une liaison en trait plein dans
une représentation plane des cycles. Par contre, un substituant placé en
dessous du plan est dit orienté en a et indiqué par une liaison en tirets pointillés.
Dans le cholestérol le OH en 3 est
en b (on dit que c'est un composé 3b-OH), les H en 9 et 14 sont en a, le H en 8 est en b.
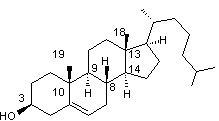
Enfin lorsque le sujet ne nécessite pas une connaissance approfondie de la
stéréochimie ou lorsque celle-ci est bien connue on peut adopter une représentation
plane plus simple :
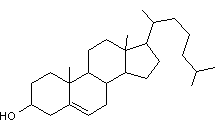
Les cycles B et C sont accolés de
manière trans puisque les H en 8 et 9 sont l'un b et l'autre a ; il en est de même pour les cycles C et D car le CH3
en 13 est b et le H en 14 est a.
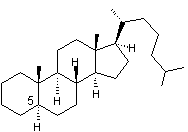
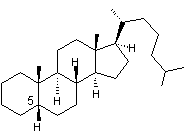
Par réduction du cholestérol
(hydrogénation de la double liaison et réduction de la fonction alcool), on
obtient deux hydrocarbures, le cholestane et
le coprostane, qui ne diffèrent que par la
stéréochimie de la jonction des cycles A et B:
|
|
|
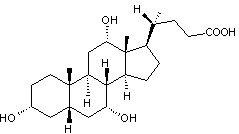
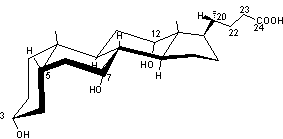
Autre exemple : Un acide biliaire, l'acide
cholique
|
|
|
Son nom systématique étant l'acide 3a,7a,12a,trihydroxy,5b-cholane-24-oïque.
Les cycles A et B sont accolés de
manière cis (on dit 5b);
Les cycles B et C ainsi que C et D
sont accolés de manière trans.
2) Quelques
stéroïdes :
Les stéroïdes sont classés en
fonction de leur structure. On les appelle parfois improprement des stérols;
cette appellation doit être réservée aux stéroïdes ayant une fonction alcool .
Ce sont des composés biologiques de
première importance; les acides biliaires, les hormones sexuelles ou
corticosurrénales, les vitamines D sont des stéroïdes.
Des exemples:
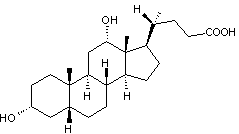
- Quelques acides biliaires :
|
Acide cholique |
(3a,12a,dihydroxy,5b-cholan-24- oïque) |
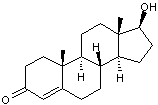
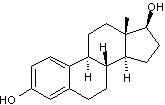
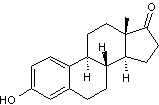
- Quelques hormones sexuelles :
|
|
|
|
|
|
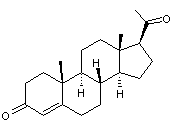
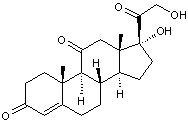
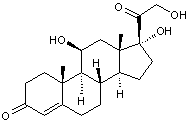
- Hormones produites par les
corticosurrénales :
|
|
|
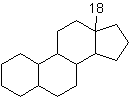
Remarque: Les stéroïdes hormonaux,
peuvent être classés en 3 groupes suivant leur squelette carboné; ils peuvent
dériver :
|
|
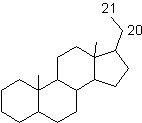
*de l'androstane 19 carbones |
|
L'ensemble de ces squelettes
dérivant du gonane 17 carbones ; c'est la forme du noyau stérane représentée
ci-dessous, compte-tenu des articulations cis-trans des cycles.
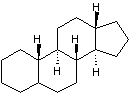
- Vitamines D:
|
|
|
3) Biosynthèse
du cholestérol :
La biosynthèse à partir de l’acide
acétique et du coenzyme A débute
comme celle des terpènes :

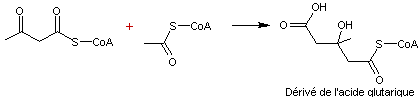
Puis un composé à chaîne ramifiée se
forme ; en effet l’acétoacétylcoenzyme A donne une addition aldolique avec
la fonction cétone de l’acétylcoenzyme A, pour donner un dérivé de l’acide
glutarique, l'HydroxyMéthylglutaryl – CoA
(HMG – CoA) :
Par réduction grâce à HMG – CoA réductase on passe ensuite à l’acide mévalonique :
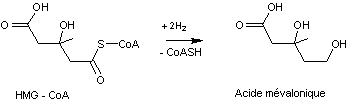
La formation de l’unité isoprène se fait d’abord par phosphorylation des
2 groupes alcool de l’acide mévalonique (grâce à l’ATP) puis il y a élimination
d’eau avec formation d’une double liaison C=C, puis décarboxylation (-CO2),
l’ensemble conduisant au 3-méthylbut-3-ènylpyrophosphate :
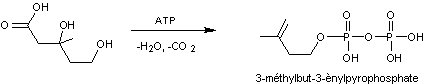
Il y a ensuite isomérisation du
composé obtenu grâce à un enzyme (l'isopentényl-isomérase) ayant un groupement
S-H (E-SH)
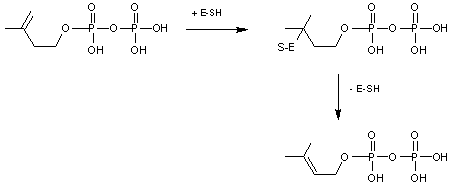
Puis il y a formation d’un carbocation :
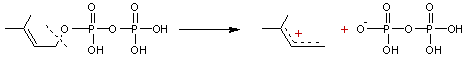
Ce carbocation agit sur une autre
molécule de 3-méthylbut-3-ènylpyrophosphate et l’on obtient du
géranylpyrophosphate après élimination d’un ion H+ :
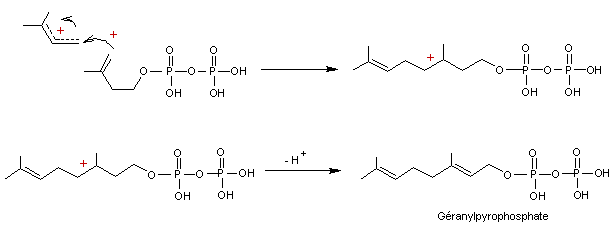
L'enzyme
intervenu dans ces réactions est le farnésyl-pyrophosphate synthétase.
Le géranyl-pyrophosphate constitue
la base (le substrat) de la synthèsedes terpènes.
Une autre réaction de ce type peut
avoir lieu entre le géranylpyrophosphate et le
3-méthylbut-3-ènylpyrophosphate pour conduire au farnésylpyrophosphate,
réaction catalysée aussi par le farnésyl-pyrophosphate synthétase :
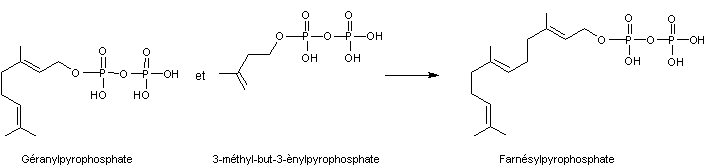
A ce stade, deux molécules de
farnésylpyrophosphate peuvent s’unir (grâce à la squalène synthétase) lors d’un
couplage en milieu réducteur pour donner le squalène :
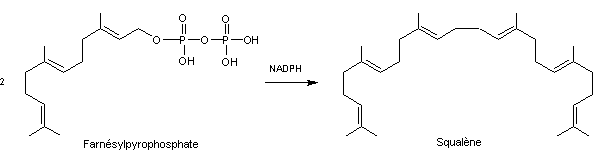
Les Hydrogènes sont fournis par le
NADPH ; l'hydrolyse des esters pyrophosphoriques fournira l'énergie et rendra
la réaction irréversible.
On peut présenter différemment le
squalène dans l’espace par rotation autour des simples liaisons C-C. :
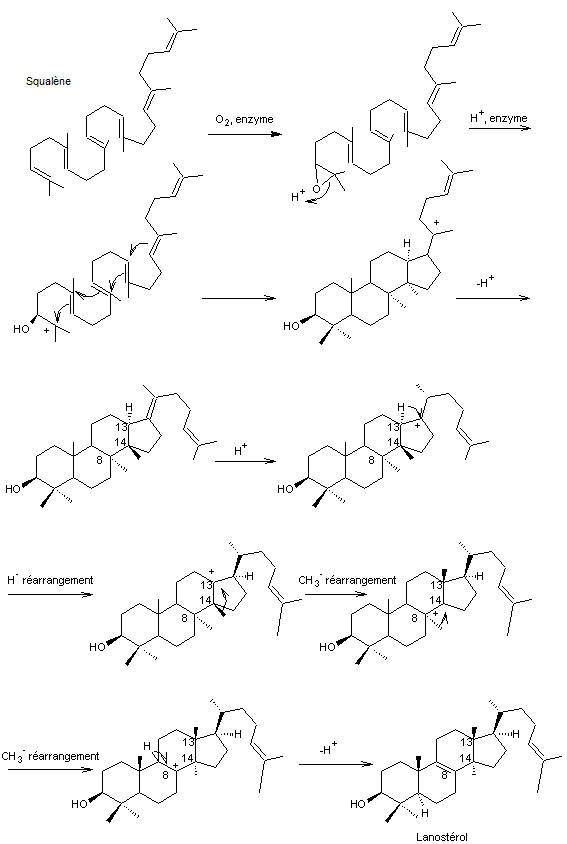
A partir du squalène la biogénèse du
cholestérol peut se schématiser :
![]()
Une molécule de squalène subit une
oxydation enzymatique (grâce au squalène époxydase) sur la double liaison C3-C4
suivie de l'ouverture en milieu acide de l'oxacyclopropane formé ; ce qui revient
à la formation d'une fonction alcool sur le carbone 3. On assiste ensuite à une
cyclisation du squalène ainsi transformé par le processus synchronisé
suivant suivi de divers réarrangements conduisant au lanostérol :
La conversion du lanostérol en
cholestérol implique le départ de 3 groupes méthyl en position 4,4,14 par
oxydation en CO2, le glissement de la double liaison C8-C9
vers C5-C6 ainsi que la réduction de la double liaison C24-C25.
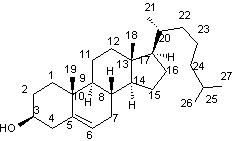
Cholestérol