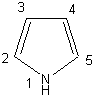QUELQUES COMPOSES AROMATIQUES
ou anti-aromatiques
1) Règle de Hückel
:
Un composé est aromatique si :
- il est
cyclique.
- tous les atomes
du cycle possèdent une orbitale p.
- il est plan (ou
quasiment plan) de façon à permettre un recouvrement des orbitales p (celles-ci
sont donc perpendiculaires au plan du cycle).
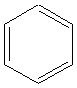
- il possède 4n+2 électrons p , avec n entier, valant 1,2,3,...... engagés dans le
recouvrement des orbitales , ainsi le benzène (6 électrons p
donc n=1); le [18]annulène * ( 18 électrons p
donc n=4)...
- de la
délocalisation des électrons p résulte une diminution de l'énergie électronique.
Exemple du benzène

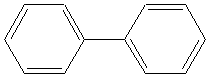
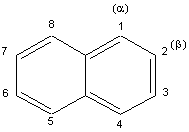
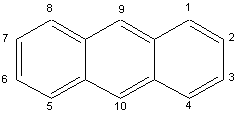
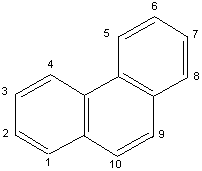
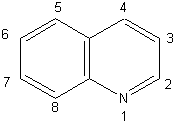
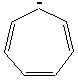
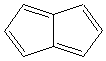
2) Exemples d'hydrocarbures
aromatiques:
|
|
|
||
|
|
|
||
|
|
|
||
|
|
|
||
|
|
AZULENE |
|
|
|
|
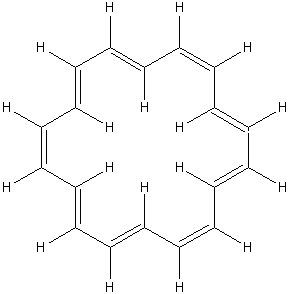
[18]ANNULENE |
|
3) Exemples
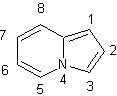
d'hétérocycles aromatiques:
La règle de Hückel peut être étendue à des hétérocycles :
|
|
|||
|
|
|
||
|
|
|
||
|
INDOLIZINE (C8H7N) |
|
|
|
4) Exemples
d' ions aromatiques :
Elle peut être
aussi être étendue à des ions.
|
|
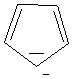
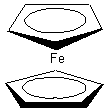
Par exemple le ferrocène
(molécule ci-dessous) qui est un complexe métallocène
dans lequel un ion fer (II) est inséré entre deux anions cyclopentadiènyle
disposés dans deux plans parallèles est un composé aromatique. Les deux
cycles, plans et conjugués, possèdent six électrons p délocalisés. Ils sont donc aromatiques et peuvent par
conséquent donner lieu à des réactions de substitution électrophile
aromatique (Voir TP acylation du ferrocène).
|
5) Exercices
Exercice 1 :
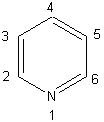
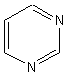
La paire
d'électrons portée par l'azote dans la pyridine,
intervient-elle dans la délocalisation des électrons p du cycle, qui confère à celui-ci son
caractère aromatique?
Réponse : non ; à la paire
d'électrons portée par l'azote correspond une orbitale perpendiculaire aux 6
orbitales p du système p.
Exercice
2 :
Pourquoi le pyrrole est-il aromatique?
Réponse :

Exercice
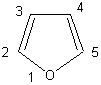
3 :
Le furanne est-il aromatique?
Réponse: oui ; une paire d'électrons "p" de l'oxygène participe à la délocalisation des électrons p du cycle, qui confère à celui-ci son caractère aromatique, tandis que l'autre paire d'électrons "p" n'intervient pas dans cette délocalisation.

6) Composés anti-aromatiques :
Ce sont des
composés cycliques plans qui ont des liaisons p conjuguées et dont tous les atomes du cycle ont des
orbitales p qui peuvent se recouvrir ....La seule différence avec les composés
aromatiques est que la délocalisation des électrons p entraîne une augmentation de l'énergie
électronique.
Un composé antiaromatique possède 4n électrons
avec n qui est un entier valant 1,2,3...
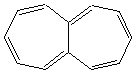
Exemples
de composés anti-aromatiques :
|
Cyclobutadiène |
|
|
Anion cycloheptatriènyle |
|
|
Pentalène |
|
|
Heptalène |
|
* Le [18] annulène (dont
le nom officiel est le cyclooctadéca-1,3,5,7,9,11,13,15,17-nonaène (C18H18)) a été préparé pour la
première fois par Sondheimer en 1956. Ce chimiste proposa la
généralisation de cette appellation ([N] annulène
avec N correspondant au nombre d’électrons π) aux hydrocarbures
monocycliques totalement conjugués ; ainsi le cyclobutadiène
est le [4] annulène, le benzène, le [6] annulène et le cyclooctatétraène,
le [8] annulène.