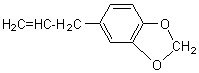LES PHENOLS
Plan du cours :
1) Définition-Nomenclature
:
2) Quelques
exemples :
3) Propriétés
chimiques :
3-1) Dues à OH :
3-2) Dues au noyau aromatique :
4) Préparations
:
5) Résumé
:
1) Définition-Nomenclature
:
Un phénol est une
molécule aromatique, possédant un groupe hydroxyle OH fixé sur un carbone d'un
cycle benzénique.
Formule générale
: Ar-OH
Exemples :
![]() Le phénol ou benzophénol
Le phénol ou benzophénol 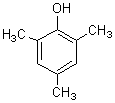 Le
2,4,6-triméthylphénol
Le
2,4,6-triméthylphénol
Nomenclature :
Lorsque plusieurs fonctions existent sur le cycle benzénique on utilise le
suffixe phénol si la fonction est prioritaire, ou le préfixe hydroxy si elle ne l'est pas.
Exemples:
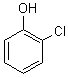
2-chlorophénol ou 2-chlorobenzophénol car OH est prioritaire par rapport à Cl.
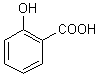
acide 2-hydroxybenzoïque car OH n'est pas
prioritaire par rapport à COOH.
Remarque: Si le groupe hydroxyle n'est pas fixé directement sur le carbone
du cycle benzénique, ce n'est pas un phénol mais un alcool aromatique;
exemple:

alcool benzylique.
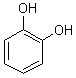
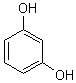
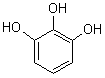
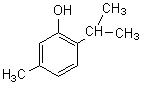
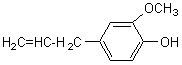
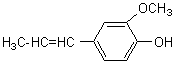
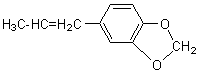
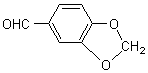
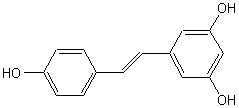
2) Quelques exemples de phénols :
|
|
|
||
|
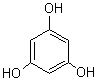
Phloroglucinol |
Les phénols sont courants dans les
essences végétales: |
||
|
|
|
||
|
|
|
|
Remarque: L'estragole, l'anéthole, le safrole, l'isosafrole et le pipéronal sont des dérivés de phénols (éthers-oxydes dérivant respectivement du chavicol, de l'anol, de l'eugénol, de l'iso-eugénol et du vanillal).
3)Propriétés chimiques :
3-1) Propriétés dues au OH :
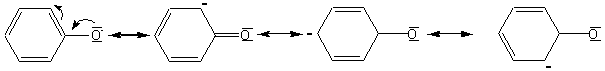
a) caractère acide- formation de l'ion phénolate:
Le caractère
acide est plus marqué que pour les alcools car l'ion phénoxy
est stabilisé par résonance:
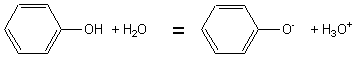
Le pKa du benzophénol est environ
10; son caractère acide est donc moins marqué que pour l'acide éthanoïque
par exemple (pKa 4,7), mais beaucoup plus marqué que
pour l'éthanol de pKa environ égal à 18.
* Action des bases
alcalines :
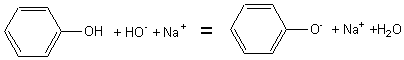
Il
se forme du phénolate de sodium (on dit aussi phénate) par une réaction qui est
presque totale.
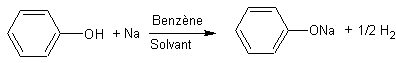
*Action
directe d'un métal:
Le
sodium et le potassium, métaux alcalins, peuvent réagir sur les phénols pour
donner également des phénolates de sodium ou de potassium avec dégagement de
dihydrogène, comme sur les alcools.
b) Estérification -Acylation :
*
Estérification :
Elle
est difficile avec les acides carboxyliques (avec l'acide acétique on obtient
par exemple 0,08 mole d'ester):
![]()
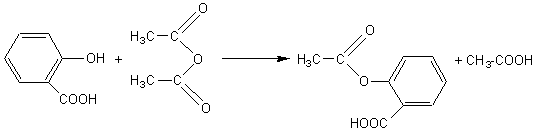
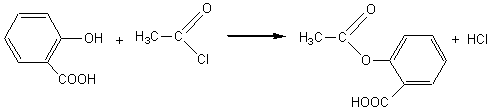
* Acylation
:
Les
anhydrides ou les chlorures d'acyle, par contre, réagissent facilement par une
réaction totale.
L'acide salicylique par exemple conduit à l'aspirine (acide acétylsalicylique):
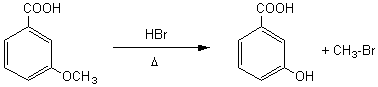
c) Formation d'éthers ; réaction de Williamson :
La
déshydratation intermoléculaire d'un phénol est possible en chauffant à 420°C
en présence de thorine (ThO2). On aboutit à un éther oxyde
symétrique:
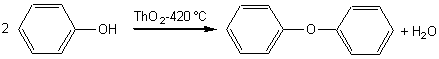
Pour
obtenir des éthers dissymétriques on utilise la réaction de Williamson .
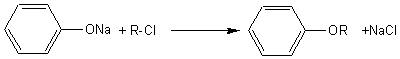
3-2) Propriétés dues au noyau aromatique :
a) Propriétés habituelles :
Les
substitutions électrophiles sur le noyau aromatique sont facilitées par
rapport au benzène, du fait de la présence du groupe OH; elles ont lieu en
ortho et para de ce groupe..
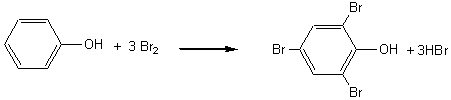
*Halogénation:
à
froid en présence de dibrome la réaction est
immédiate et conduit au tribromophénol. Avec le dichlore, on peut s'arrêter au monochlorophénol
ou au dichlorophénol, mais on peut aussi aller
jusqu'au dérivé trichloré.
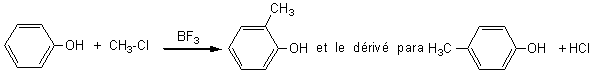
*Alkylation
:
Réaction de
Friedel et Crafts qui nécessite BF3 au lieu de AlCl3 (Ce catalyseur ne
pouvant être utilisé avec un phénol):
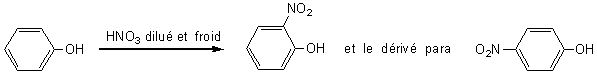
*Nitration:
à froid, avec
de l'acide nitrique dilué, on obtient le mononitrophénol
:
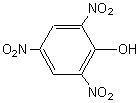
L'acide
picrique qui est le 2,4,6-trinitrophénol s'obtient
indirectement (Sulfonation préalable pour obtenir l'acide 2-hydroxybenzène-1,3,5-trisulfonique puis traitement par l'acide nitrique à chaud
en présence de nitrate de sodium) ; c'est un acide fort (pKa
= 0,38) grâce aux trois groupes NO2 attracteurs d'électrons, qui augmentent la
mobilité du H du groupe OH :
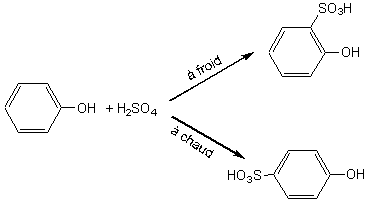
*Sulfonation
:
Avec l'acide
sulfurique, à froid, il se forme l'isomère ortho ; à chaud il se forme de
préférence le dérivé para.
*Action sur
les sels de diazonium :
En milieu
alcalin, l'ion phénoxy attaque les sels de diazonium, et l'on obtient un azoïque phénol colorant
soluble en milieu basique.
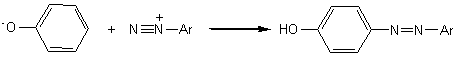
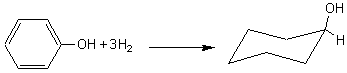
Les additions se font sur les 6 carbones à la fois.
L'hydrogénation conduit à des alcools secondaires cycliques:
b) Quelques réactions particulières :
*Réaction de
Reimer et Tiemann :
Formylation d'un phénol par
action du trichlorométhane (chloroforme) en milieu
basique :
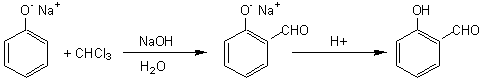
* Réaction de Kolbe:
Il
s'agit d'une réaction de carboxylation du benzophénol (son sel de sodium) sous l'action de CO2 à 125°C
et sous pression (5bars):
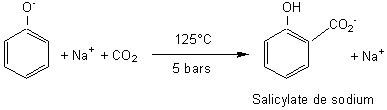
*Réactions
de condensation :
Les H en para
du groupe hydroxyle, permettent des réactions de condensation; avec l'anhydride
phtalique par exemple on obtient la phtaléine du phénol, utilisée comme
indicateur coloré dans les réactions de dosage acido-basique.
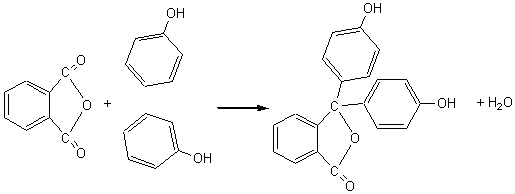
A pH < 8 la
phtaléine du phénol est incolore; en milieu franchement basique elle est rouge
(prédominance de la forme quinonique):

*Réactions d'oxydation :
En
milieu acide sulfurique, à froid, le permanganate de potassium oxyde le benzophénol en o. et p. diphénol qui sont eux-mêmes oxydés
en o.et p.quinones. En présence d'un excès d'oxydant
il y a ouverture du cycle.
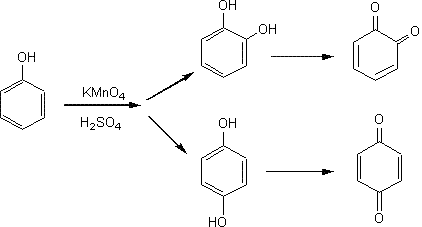 paraquinone (la
molécule du dessus étant l'orthoquinone).
paraquinone (la
molécule du dessus étant l'orthoquinone).
4)
Préparations :
4-1) Par fusion alcaline :
Pour le benzophénol, c' est
une ancienne préparation dont le point de départ était le benzène; le chemin
des réactions était le suivant:
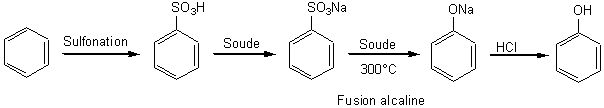
Pour les autres phénols cette
préparation est toujours utilisée.
4-2) A partir du cumène:

Remarque:
Industriellement
c'est le propène qui est utilisé à la place du 2-chloropropane,
le catalyseur conduisant au carbocation électrophile étant un acide protonique
(acide sulfurique par exemple).
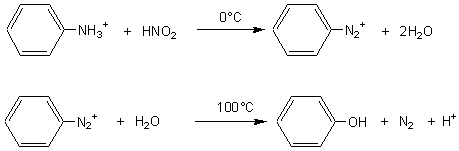
4-3) Désamination nitreuse d'une amine aromatique :
La
suite de réactions est la suivante, diazotation d'une
amine aromatique, puis hydrolyse à chaud du sel de diazonium
obtenu:
4-4) A partir des alkoxybenzènes
: