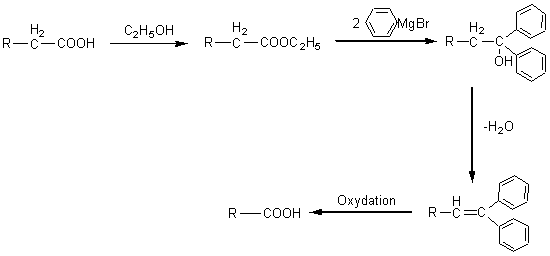
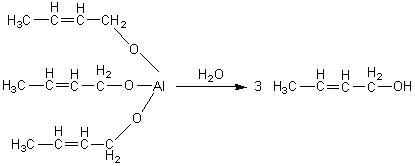
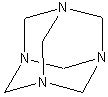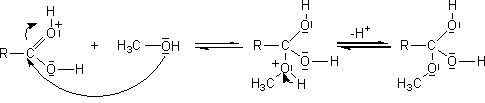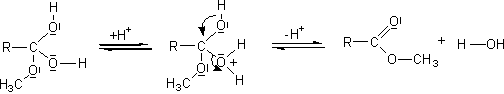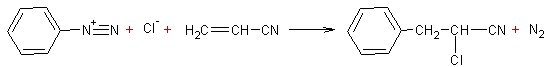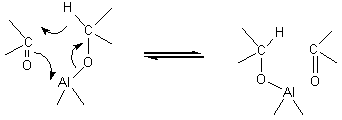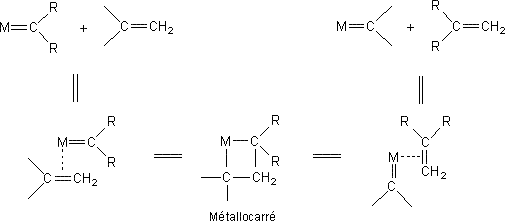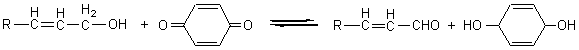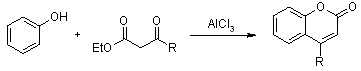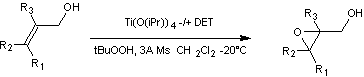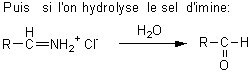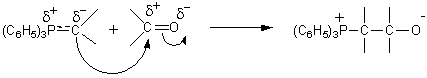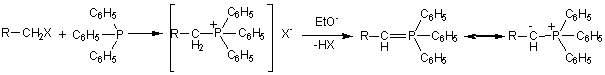QUELQUES REACTIONS DE
BASE (2)
Plan de l'étude:
|
ADKINS (oxosynthèse) |
||
|
ADKINS(réduction des
acides) |
FRIES (réarrangement de) |
REPPE (oxosynthèse) |
|
GATTERMANN-KOCH
(oxosynthèse) |
||
|
ROBINSON (annellation
de) |
||
|
ROSENMUND (Procédé) |
||
|
BAEYER-VILLIGER
(oxydation) |
HANTZSCH (synthèse
pyridinique) |
|
|
HANTZSCH (synthèse du
pyrrole) |
||
|
BECKMANN (transposition
ou réarrangement) |
||
|
BIRCH (réduction de) |
||
|
HINSBERG (test) |
||
|
BOUVEAULT ET BLANC
(réaction de) |
||
|
BUCHERER (réaction de) |
HOFMANN (élimination) |
|
|
CARROLL (réarrangement
de) |
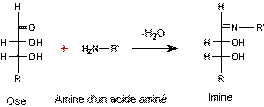
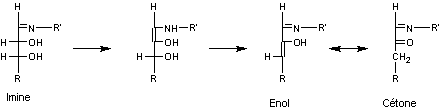
KILIANI-FISCHER
(allongement d'un ose) |
SHARPLESS (réaction de) |
|
SKRAUP (synthèse de) |
||
|
CHICHIBABIN (SN sur
cycle pyridinique) |
KNORR (synthèse) |
SOMMELET (réaction de) |
|
CHUGAEV
(Elimination de) |
||
|
CLAISEN (condensation) |
STEGLICH
(estérification de) |
|
|
CLAISEN
(réarrangement) |
MADELUNG (réaction de) |
|
|
COPE (réarrangement de ) |
MALONIQUE (synthèse) |
|
|
CORNFORTH (réarrangement de) |
||
|
DARZENS
(condensation) |
||
|
DELEPINE
(méthode de) |
MERRIFIELD (procédé) |
WAGNER-MEERWEIN (réarrangement
de) |
|
DIAZOMETHANE (synthèses avec le) |
WIDMAN-STOERMER (réaction de) |
|
|
MICHAEL (addition) |
WILGERODT (réaction
de) |
|
|
DIECKMANN
(condensation) |
||
|
OPPENAUER (méthode d') |
||
|
PAAL-KNORR (synthèse) |
WOLFF-KISHNER
(réduction) |
|
|
PAULY réaction de) |
||
|
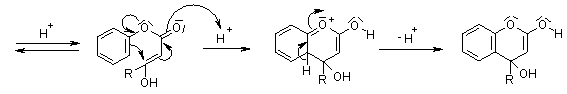
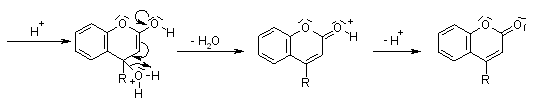
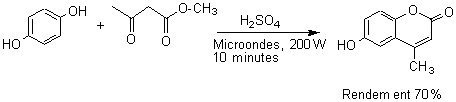
PECHMANN (condensation) |
||
|
PERKIN (réaction) |
||
|
|
|
BARBIER-WIELAND |
|
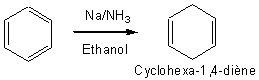
BIRCH |
|
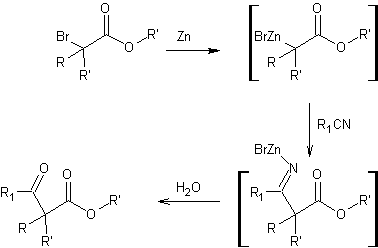
Réaction
dérivée de la réaction de Reformatsky. Il s'agit de la formation d'un β-cétoester
à partir d'un α-bromoester traité par le zinc.
|
|
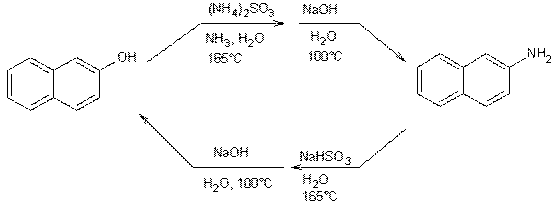
BUCHERER
(Hans Theodor Bucherer 1869-1949 savant
allemand) Sous
l'action d'un sulfite les naphtols peuvent réversiblement se transformer en
naphtylamines :
|
|
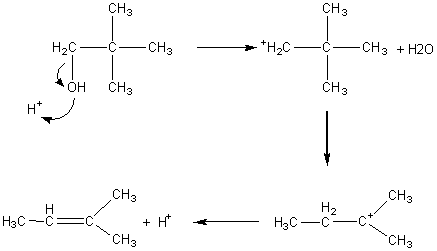
ELIMINATION DE CHUGAEV Il
s’agit de la préparation d’un alcène à partir d’un alcool. L’alcool, après avoir
été transformé en méthylxanthate, en milieu basique, par action sur du
disulfure de carbone puis de l’iodure de méthyle, est pyrolysé à 200°C.
L.A. Tschugaeff
(simplifié en Chugaev) est un chimiste Russe né en 1873 et mort en 1922. |
|
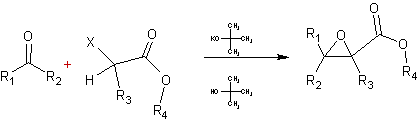
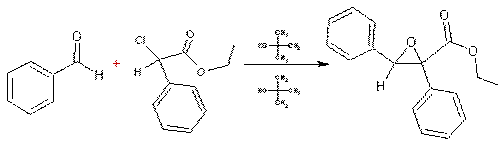
(Réaction
ou condensation de) Réaction
qui date de 1904 ; c'est la condensation d'un composé carbonylé avec un
α-halogénoester en présence d'une base forte pour donner un ester
α,β-époxydé (oxirane) suivant l'équation générale suivante :
Exemple :
Le mécanisme
de cette réaction :
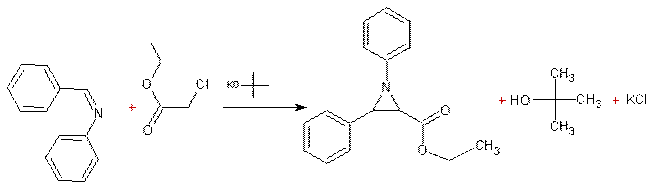
Remarque : Cette
réaction est un peu plus générale et permet aussi d'aboutir à des composés
azotés (dérivés de l'azacyclopropane) comme le montre l'exemple suivant : On peut
donc d'une façon plus générale définir la réaction de Darzens comme une
réaction permettant de synthétiser des hétérocycles triatomiques. |
|
DELEPINE (CH2)6N4. |
|
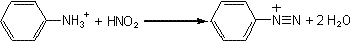
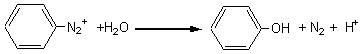
DIAZOTATION(cas des amines
aromatiques primaires)
En partant du nitrite de sodium Remarque
1:
L'acide nitreux est instable à température ordinaire, il se décompose par une
réaction de dismutation: et le
conserver à 0°C pendant le temps de la réaction (cela diminue la vitesse de
décomposition par dismutation). |
|
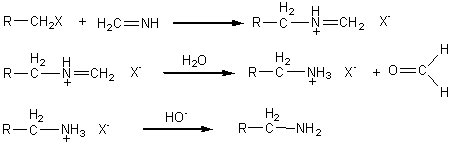
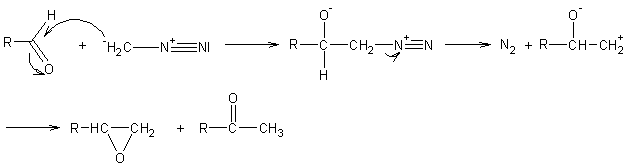
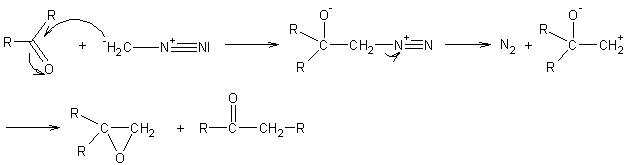
Le
diazométhane composé très réactif permet de nombreuses synthèses parmi
lesquelles : - La réaction
de Arndt-Eistert qui permet de
passer d’un acide carboxylique à son homologue supérieur –COOH → -CH2-COOH
mais aussi de passer d’un acide carboxylique à un ester de son homologue supérieur ou
à un amide de son homologue
supérieur . - Mais il
permet aussi de passer d’un aldéhyde à une cétone,
et d’une
cétone à une cétone homologue :
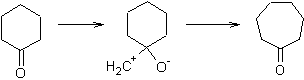
Remarque
1 : On peut
utiliser cette réaction pour agrandir le cycle d’une cétone cyclique :
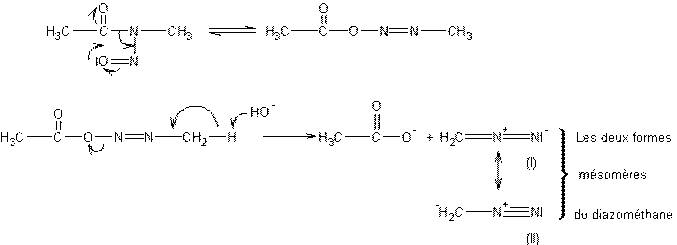
Remarque 2 : Le diazométhane se prépare à partir de nitroso-amides. Ceux-ci
en milieu alcalin s’isomérisent en diazo-esters puis se scindent :
- L'action du chlorure d'éthanoyle sur le diazométhane conduit à un
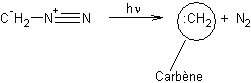
carbène substitué plus stable que le carbène :
- Le carbène, lui peut dériver du diazométhane par photolyse :
|
|
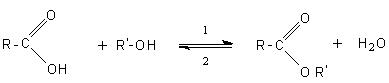
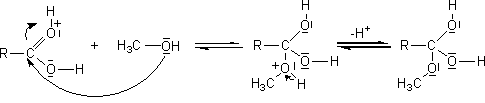
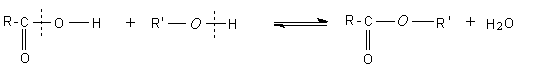
ESTERIFICATION |
|
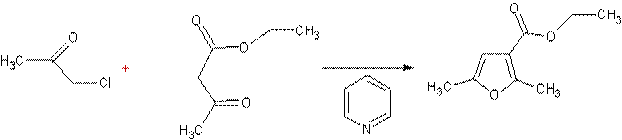
C'est une synthèse du furanne par réaction d'un β-céto ester avec
une α-chlorocétone ou un α-chloro-aldéhyde en présence de pyridine
(elle se rapproche de la synthèse de Hantzsch du pyrrole).
|
|
La réaction de Fenton*
consiste en la production de radicaux hydroxyles, à partir de fer au degré
d’oxydation II et d’eau oxygénée, selon l’équation
Pour optimiser la réaction
de Fenton, plusieurs équipes de recherche ont proposé de rajouter un
réducteur au système. Récemment, une équipe chinoise a rapporté l’étude d’un système
utilisant l’acide ascorbique comme réducteur pour activer le procédé. Les auteurs présentent des
nanofils constitués de particules de fer recouvertes d’une couche d’oxyde Fe2O3
notés Fe@Fe2O3. Lorsque ces fils sont mis en présence
d’acide ascorbique et d’eau oxygénée, ils obtiennent un milieu capable de
dégrader des composés organiques résistants. La réaction de Fenton est
couramment utilisée pour dégrader des composés organiques toxiques à travers
des réactions d’oxydation poussées. Cette réaction est largement employée
dans les procédés de traitement des eaux polluées par des composés
organiques. Ce type de dispositif est cependant contraint par un pH
d’utilisation très restreint (solution très acide) ou encore par la
production de boues ferriques. * Henry John Horstman Fenton (Février 1854 – Janvier 1929) est un chimiste britannique
inventeur en 1890 de la réaction qui porte son nom et qui permet grâce à une
solution d'eau oxygénée et d'un catalyseur à base de fer d'oxyder les
polluants organiques des eaux usées. |
|
FISCHER-TROPSCH |
|
FITTIG |
|
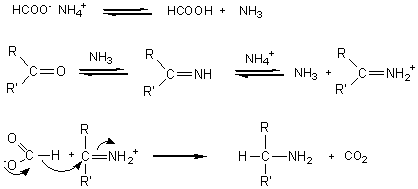
LEUCKART |
|
MAILLARD (réaction de)
|
|
MEERWEIN (réaction de) Il s'agit de l'action d'un sel d'aryldiazonium sur les alcènes :
Mécanisme :
Cette réaction est en compétition avec la réaction de Sandmeyer ; cette dernière est
favorisée s'il y a un excès de Cu(II). |
|
MEERWEIN-PONNDORF-VERLEY |
|
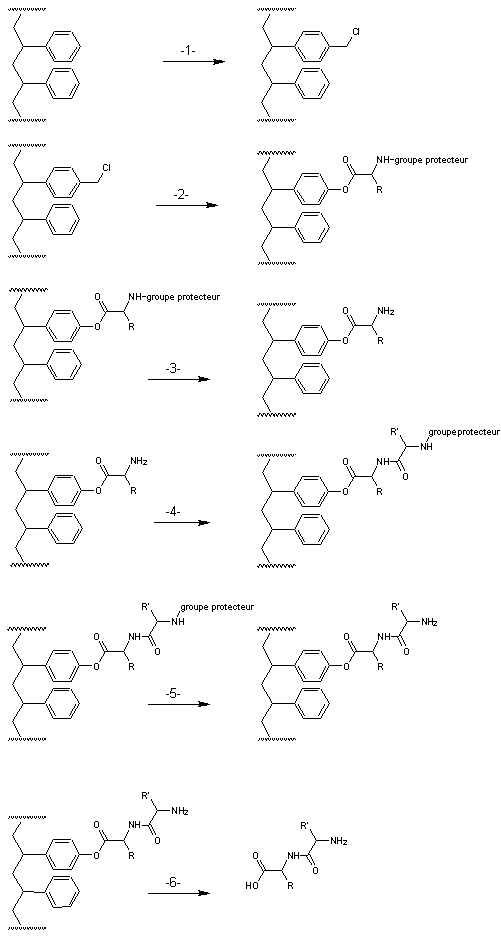
MERRIFIELD
(Procédé
de préparation de peptides) Principe de préparation d'un
dipeptide : On utilise un polymère sur lequel
on greffe un groupement susceptible de réagir avec l'extrémité carbonyle d'un amino-acide. On peut ainsi ancrer cet
amino-acide sur une matrice solide. A partir du groupe amino libre de
l'amino-acide ainsi fixé, on peut on peut fixer un deuxième acide aminé par
son extrémité carbonyle et obtenir un dipeptide que l'on peut décrocher de la
matrice. Ainsi, par exemple à partir du
polystyrène :
-1- On greffe le groupe –CH2-Cl
(chlorométhylation) par substitution électrophile sur quelques noyaux
benzéniques du polymère, groupe susceptible de réagir avec le groupe
carbonyle d'un amino-acide. -2- On fait réagir un amino-acide
dont on a protégé la fonction amine
sur la matrice ainsi transformée. -3- On enlève la protection du
groupe amino
-4- On fait réagir un nouvel acide
aminé dont on a protégé la fonction amine sur la fonction amine libérée.
-5- On enlève la protection du
groupe amino -6- On détache le dipeptide ainsi formé
de la matrice. Avantages et extension du procédé : Le fait que les intermédiaires
formés à chaque étape sont solidement fixés à la matrice solide, permet
d'enlever facilement les réactifs
excédentaires et les produits formés
du milieu réactionnel avant l'étape suivante. On peut continuer à greffer des
amino-acides et créer des peptides plus longs. Merrifield a conçu un appareil
automatisé permettant de répéter les séquences ci-dessus décrites et capable
ainsi de préparer un polypeptide en un temps considérablement réduit. C'est ainsi qu'il réalisa la
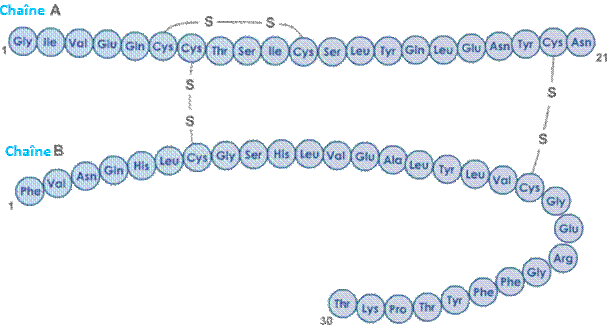
première synthèse totale des deux chaînes de l'insuline :
|
|
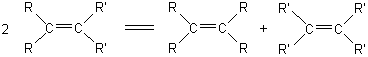
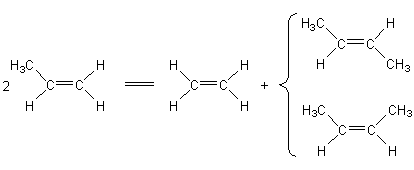
METATHESE (du grec metaqesiz ) |
|
Faite et décrite par
le chimiste John Nef en 1894 ; il a traité par l'acide sulfurique le sel de
sodium du nitroéthane et a obtenu de l'éthanal avec un rendement de 70% ; il
se forme dans cette réaction de l'oxyde nitreux.
|
|
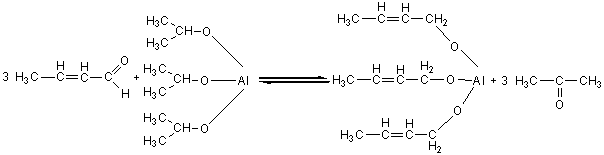
OPPENAUER |
|
PECHMANN |
|
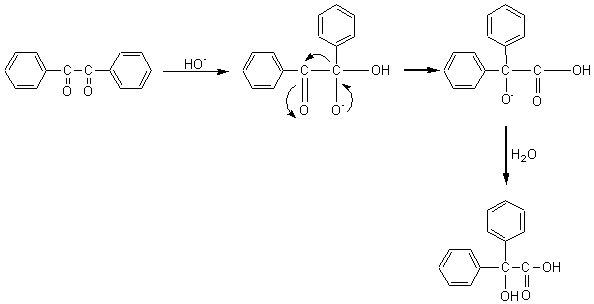
REARRANGEMENT BENZYLIQUE
|
|
SABATIER ET SENDERENS |
|
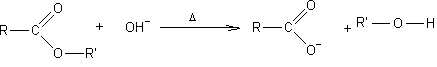
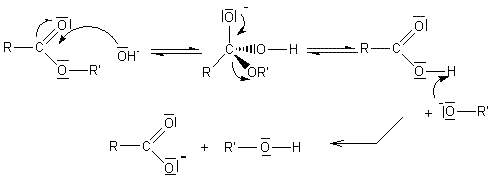
SAPONIFICATION |
|
K.B. SHARPLESS C'est une réaction
d'époxydation énantiosélective qui permet de préparer des 2,3-époxyalcools à
partir d'alcools allyliques.
3A Ms : Tamis
moléculaire 3Å DET : Tartrate de
diéthyle
|
|
SOMMELET . |
|
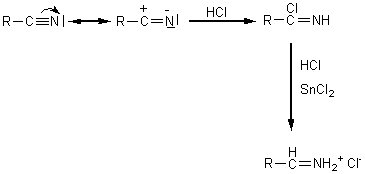
STEPHEN |
|
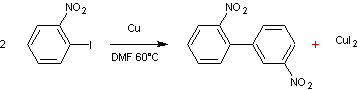
Il s'agit d'un
couplage entre deux halogénures d'aryle en présence de cuivre. Exemple :
On peut à la place de
l'iode, utiliser le brome. |
|
WAGNER-MEERWEIN |
|
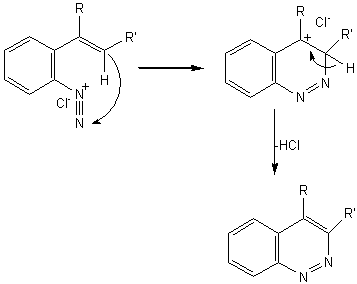
WIDMAN-STOERMER |
|
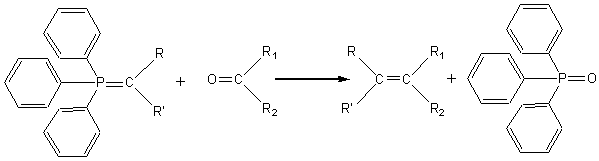
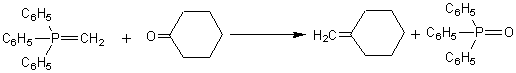
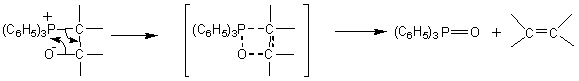
WITTIG
|