AMINES AROMATIQUES
Plan d'étude:
1) La
famille des amines
2) L'aniline
3) Nomenclature des amines
4) Propriétés
chimiques principales de l'aniline et des amines aromatiques
5) Autres
réactions chimiques
6) Réactions
mettant en jeu le noyau aromatique
7) Préparations:
8) Résumé:
1)La
famille des amines:
Une amine dérive
de l'ammoniac NH3 par remplacement d'un ou plusieurs hydrogènes par un groupe
alkyle ou aryle.
- Si tous les groupes liés à l'azote sont des alkyles(R-) l'amine est dite aliphatique.
- Si au moins un groupe est un radical aryle (Ar-) l'amine est dite aromatique.
Les amines aliphatiques et
aromatiques présentent des propriétés communes, mais la présence d'un noyau
aromatique confère aux amines aromatiques des propriétés particulières.
2) L'aniline:
C'est l'amine aromatique la plus simple:

Son nom dérive
du nom de l'indigo (extrait d'une plante des régions chaudes, en particulier le
Salvador, Indigofera anil) d'où on
l'extrayait autrefois.
C'est un liquide relativement visqueux, incolore, mais qui brunit rapidement à
l'air et à la lumière car il s'oxyde. Souvent, avant d'entreprendre une
synthèse, on enlève les impuretés colorées en chauffant l'aniline avec du noir
animal ou végétal. On peut la distiller sous pression réduite car sa
température d'ébullition est 182°C sous la pression atmosphérique.
L'aniline est
légèrement soluble dans l'eau et sa densité par rapport à l'eau est 1,02.
3) Nomenclature
des amines :
 a) Phénylamine
a) Phénylamine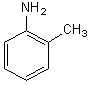 b) 2-méthylphénylamine
b) 2-méthylphénylamine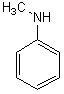 c) N-méthylphénylamine
c) N-méthylphénylamine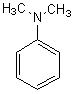 d) N,N-diméthylphénylamine
d) N,N-diméthylphénylamine
Les amines a)
et b) sont primaires, l'amine c) est secondaire et l'amine d) est tertiaire.
4) Propriétés
chimiques principales de l'aniline et des amines aromatiques, dues au
groupement amine -NH2:
4-1) Ce sont des bases:
Leur caractère
basique, aptitude d'une molécule ou d'un ion à capter un proton, est dû à la
présence d'un doublet libre d'électrons sur l'atome d'azote. La délocalisation
de ce doublet vers le noyau aromatique rend les amines aromatiques moins
basiques que leurs homologues aliphatiques. On peut expliquer de la même
manière la décroissance de la basicité des amines (I) aux amines (II), les
amines (III) n'ayant plus du tout de caractère basique.
-L'aniline  pKa =
4,6 - N-phénylaniline
pKa =
4,6 - N-phénylaniline pKa = 0,9 -N,N-diphénylaniline
pKa = 0,9 -N,N-diphénylaniline 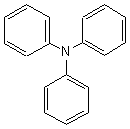 Plus du tout basique.
Plus du tout basique.
Remarque: L'aniline est très soluble dans
l'eau en milieu acide; elle se transforme en son acide conjugué, l'ion phénylammonium ou l'ion anilinium.
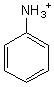 Souvent une synthèse avec l'aniline commence
par l'addition d'acide chlorhydrique, pour la solubiliser et travailler ainsi
en milieu homogène.
Souvent une synthèse avec l'aniline commence
par l'addition d'acide chlorhydrique, pour la solubiliser et travailler ainsi
en milieu homogène.
4-2) Caractère nucléophile des amines aromatiques:
La présence du
doublet libre de l'azote explique aussi pourquoi les amines sont attirées par
les sites pauvres en électrons: R+d-X-d ou R+d-OH-d .C'est leur caractère
nucléophile.
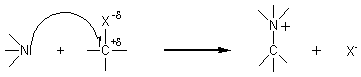

Les réactions
de Sabatier et d'Hofmann illustrent cette propriété des amines aromatiques :
Réaction de
Sabatier:

Mais
il se forme aussi 
Réaction
d'Hofmann:
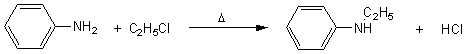
Il
se forme également
4-3) Réaction de diazotation:
C'est la réaction la plus
importante de l'aniline et des amines aromatiques primaires; il s'agit de
l'action de l'acide nitreux HNO2.
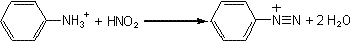
Le
composé obtenu est un sel de diazonium (voir mécanisme).
Remarque 1:
L'acide nitreux
est instable à température ordinaire, il se décompose par une réaction de dismutation:
![]()
(HNO2/NO E0 =1,00V
) et (NO3-/HNO2 E0 =0,94V )
Il faut donc le
préparer au moment de son utilisation (in situ) par action de l'acide
chlorhydrique sur le nitrite de sodium:
![]()
et le conserver
à 0°C pendant le temps de la réaction (cela diminue la vitesse de décomposition
par dismutation).
Remarque 2:
Le sel de diazonium doit aussi être utilisé rapidement après son
obtention et conservé à 0°C pendant le temps de la réaction. Sa décomposition
conduit au phénol:
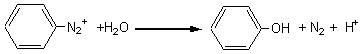
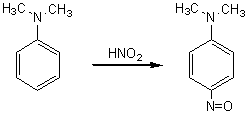
Remarque 3:
Avec l'acide
nitreux, HNO2, les
amines secondaires et tertiaires, ne donnent pas de sels de diazonium,
mais des nitrosamines:
- Amines(II)
-Amines(III)
La réaction est identique, mais elle est
suivie d'une transposition avec fixation du groupement nitroso
en para.
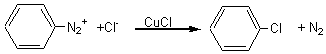
4-4) Utilisation des sels de diazonium:
a) Réaction de Sandmeyer:
C'est l' action d'un ion halogénure X-

Avec
l'ion chlorure, la réaction se fait en présence de chlorure de cuivre(I) CuCl.
b) Copulation:
L'ion diazonium peut réagir soit avec une amine aromatique soit
avec un phénol, on obtient un composé coloré: un
azoïque amine ou un azoïque phénol.

Dans l'exemple
choisi le composé obtenu est le jaune de méthyle ou jaune de beurre (car il était autrefois
utilisé comme colorant des matières grasses).
La plupart des
composés ainsi obtenus sont colorés car les nombreuses conjugaisons entre
doubles liaisons qui existent dans la molécule, déplacent le spectre d'absorption
vers le visible.
Les molécules
obtenues sont des colorants azoïques à la
condition d'être salifiables; Les azoïques phénols sont solubles dans les bases
alcalines, les azoïques amines sont solubles en milieu acide.
La réaction de
copulation est une substitution électrophile.
La copulation
avec un phénol a lieu en milieu basique; c'est l'ion phénoxy
qui réagit sur l'ion diazonium:

La copulation
avec une amine tertiaire (exemple cité plus haut) donne des azoïques amines,
solubles comme nous l'avons dit, en milieu acide.
Elle peut
également avoir lieu avec des amines primaires et secondaires mais il faut
alors un excès d'amine et opérer en milieu acide:
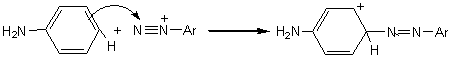
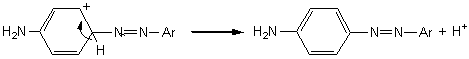
En milieu neutre ou acide faible (acide
éthanoïque), la réaction avec des amines primaires ou secondaires conduit à un triazène:
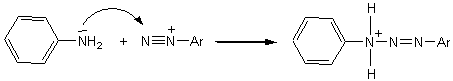

c) Obtention d'un phénol:

d) Obtention d'un
nitrile:
![]()
5)Autres propriétés chimiques dues au groupement amine -NH2:
5-1)
Mobilité des hydrogènes du groupe amine
a) Action des chlorures d'acyle ou des anhydrides:
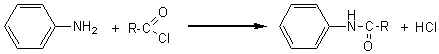
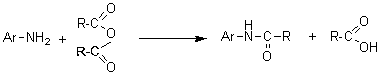
Dans les deux
cas on obtient un amide substitué sur l'azote par un groupement aromatique (anilide).Dans le cas de l'aniline et du chlorure d'éthanoyle (première équation avec R- correspondant à CH3-) on obtient le N-phényléthanamide ou N-phénylacétamide
ou acétanilide.
b) Formation d'isocyanate:

L'isocyanate de phényle, a une grande importance industrielle
(synthèse de polyuréthanes). Le réactif qui a servi à le fabriquer COCl2 est le phosgène.
5-2) Oxydation
Alors
que le benzène est difficilement oxydable, l'aniline s'oxyde facilement, c'est
la présence de la fonction amine qui explique la différence de comportement
(augmentation de la densité électronique au niveau du noyau). On obtient des
composés de couleur rouge foncé, avec la plupart des oxydants habituels
(mélange sulfochromique, trioxyde de chrome,
hypochlorites).
Avec
le chlorate de potassium on obtient un colorant noir (noir
d'aniline) utilisé comme teinture pour le coton et autres textiles ainsi que
pour certaines peausseries:
Une
des structures possibles:
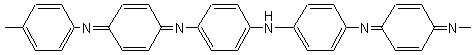
Une autre
structure avancée:

Pour teindre
les vêtements on imprègne la fibre d'une solution chlorhydrique d'aniline puis
on oxyde avec du chlorate de sodium ou de potassium, et finalement avec du
dichromate de sodium.
6) Réactions mettant en jeu le cycle aromatique:
6-1) Hydrogénation:
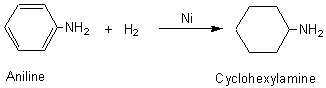
6-2)
Substitutions électrophiles:
a) Nitration:
- Sans
précaution particulière, la nitration de l'aniline conduit au dérivé méta,car la nitration a lieu en
milieu acide et que la forme acide de l'amine oriente en méta toute
substitution ultérieure (Règle de hollemann).
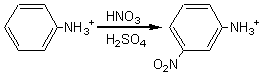
- Si l'on veut
fabriquer les dérivés ortho ou para, il faut d'abord "bloquer" la
fonction amine par acylation, puis nitrer, puis régénérer la fonction amine par
hydrolyse en milieu basique.

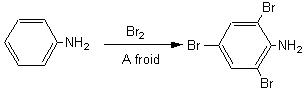
b) Halogénation:
A froid,
l'action du dibrome par exemple donne directement le
dérivé tribromé: la 2,4,6-tribromoaniline
7)Préparations:
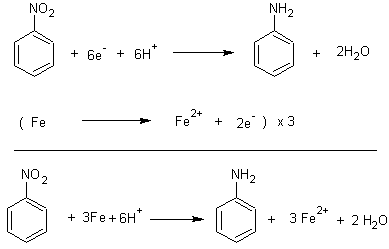
Industriellement
on l'obtient par réduction du nitrobenzène par le fer, le zinc, l'étain en
milieu acide.

Les réactions d’oxydo-réduction
s’écrivent avec le fer :