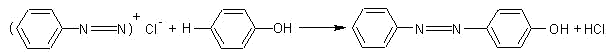MATIERES COLORANTES
ORGANIQUES
Plan de l’étude :
|
1-1)Chromophores |
1-2) Auxochromes |
1-3) Adjuvants |
|
|
|
|
2)
Les azoïques : |
2-1) Synthèse |
|
|||
|
3-1) La
fuchsine |
3-2) Le
violet cristal |
3-3) Le
bleu patenté V |
3-5) Le
vert malachite |
||
|
4)
Les phtaléines : |
4-1) Phtaléine
du phénol |
4-2) Fluorescéine |
4-3) Les
rhodamines |
|
|
|
5-1) Naphtoquinones |
5-2) Anthraquinones |
5-3) Quinones
imines |
|
|
|
|
6-1) L’indigo |
6-2) Le
carmin d’indigo |
|
|
||
|
7-1) Thiaziniques |
7-2) Oxaziniques |
|
|
|
|
|
8)
Les caroténoïdes : |
8-1) Les
carotènes |
8-2) Les
xanthophylles |
|
|
|
|
9-1) Les
flavones |
9-2) Les
anthocyanes |
|
|
|
|
|
10-1) L’ion
cupritartrique |
|
|
|||
|
11) D’autres
colorants : |
11-1) Des
rouges |
11-2) Des
jaunes |
11-3) Des noirs |
11-4) Colorants au soufre |
11-5) Des
polyphénols |
1)
Chromophores, auxochromes, adjuvants :
Une absorption dans l’UV se rencontre chez les
molécules renfermant des groupements chromophores :
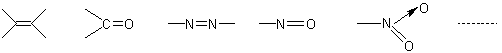
S’il y a plusieurs chromophores et notamment si
les doubles liaisons sont conjuguées ![]() ,
l’absorption se déplace vers les grandes longueurs d’onde c’est-à-dire de l’UV
dans le visible ; la molécule devient colorée (molécule chromogène) :
,
l’absorption se déplace vers les grandes longueurs d’onde c’est-à-dire de l’UV
dans le visible ; la molécule devient colorée (molécule chromogène) :
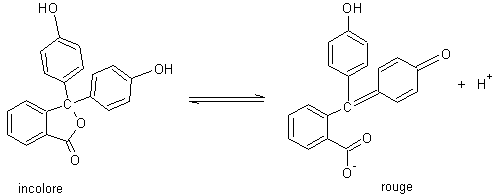
Exemple
Phtaléine du phénol incolore à pH inférieur à 8 elle
devient nettement rouge à pH 10.
L’œil perçoit les radiations de la lumière
blanche qui n’ont pas été absorbées.
Des groupes d’atomes fixés sur la molécule
chromogène provoquent un accroissement de l’intensité de la couleur (effet hyperchrome) ou un déplacement de l’absorption vers les
grandes longueurs d’onde (effet bathochrome, du grec bathos, “profondeur” et khrôma,
“couleur”). Ce sont des auxochromes :
-OH, -OR, -NH2 et ses dérivés, -R, -X
…….
Exemple :
D’autres groupes favorisent la teinture parce
qu’ils permettent la solubilité du colorant ou sa liaison avec un support. Ce
sont les adjuvants : -SO3H, -COOH, -NH2, …..
Exemple : le rouge Congo
2) Les azoïques : Ar-N=N-Ar’
Remarque : Ar et Ar’ sont
à prendre au sens large ; il peut y avoir des substituants sur les noyaux
aromatiques.
2-1) Synthèse
: la synthèse des composés azoïques s’effectue par copulation d’un diazoïque ou
sel de diazonium, généralement un chlorure ![]()
·
Avec les phénols en milieu alcalin. C’est un H en para (à
défaut en ortho) qui intervient.
Exemple :
|
|
|||
|
Remarque : par souci de simplification
pour plus de clarté, cette réaction, qui a lieu en milieu basique, a été écrite
avec C6H5-OH au lieu de C6H5-O-
et le composé obtenu C6H5-N=N-C6H4-OH
au lieu de C6H5-N=N-C6H4-O-.
Autres
exemples :
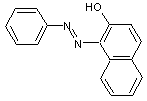
-
La
copulation du diazoïque de l’aniline avec l’α-naphtol conduit au brun
organol :
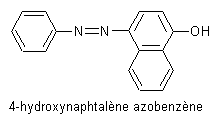
-
La
copulation du diazoïque de l’aniline avec le β-naphtol conduit au jaune
Soudan ou Sudan I ® :
|
|
|
2-hydroxynaphtalène
azobenzène |
·
Avec les amines aromatiques en milieu acide (à pH
aux environs de 5) ; l’acidité des copulants
suffit le plus souvent.
Exemples :
-
La
N,N-diméthylaniline
et le diazoïque de l’acide sulfanilique
(amine aromatique primaire) donnent l’hélianthine :

-
La
N,N-diméthylaniline
et le diazoïque de l’acide anthranilique , lui aussi amine aromatique primaire donnent le rouge de méthyle :
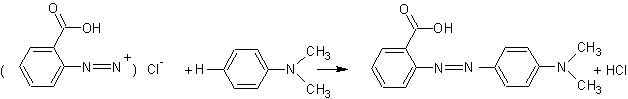
-
La
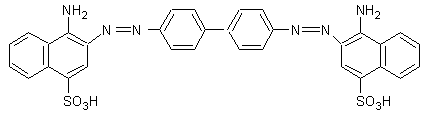
copulation du bis-diazoïque de la benzidine avec l’acide naphthionique donne le rouge Congo :
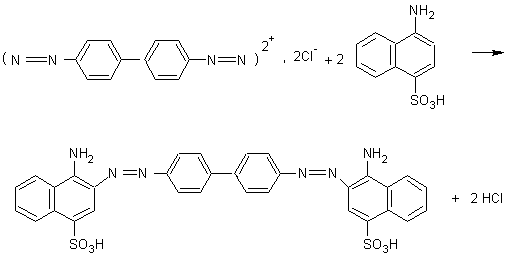
En
milieu basique :
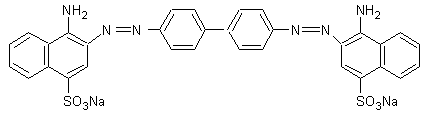
Le
rouge Congo, colorant bis-azoïque, a été préparé par Boettiger
en 1884. Ces colorants, obtenus à partir de la benzidine et d'autres diamines,
représentèrent un réel progrès comme colorants pour tissus car ils permettaient
de teindre directement le coton sans "mordant".
2-2) Des
indicateurs de pH :
Parmi
les colorants azoïques, on trouve des indicateurs colorés de réactions
acide-base très courants (en général sous forme de sel de sodium) :
-
L’hélianthine rouge orangé à pH<3,2 et jaune à pH>4,4
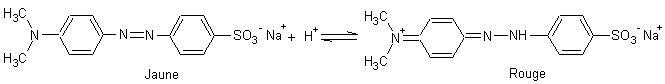
-
le rouge de méthyle rouge à pH<4,4 et
jaune pâle à pH>6,2
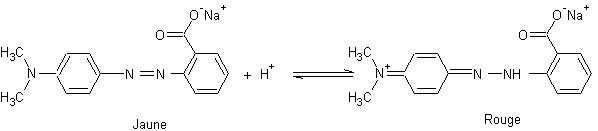
2-3) Des colorants
alimentaires :
On
trouve aussi des colorants alimentaires parmi les colorants azoïques :
-
Le jaune E 102, la tartrazine :
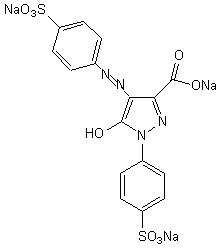
-
L’orange E
110, le jaune orangé sunset (ou jaune orangé S ou
jaune 6) ; il est aussi utilisé comme colorant de certains parfums.
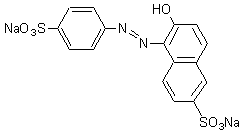
-
Le rouge E 122, l’azorubine (ou
carmoisine)
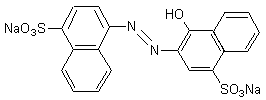
-
Le rouge E 123, l’azorubine S qui est un produit de synthèse :
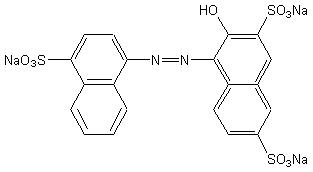
2-4) Un Indicateur de
complexation :
Le
noir ériochrome
T est
un indicateur coloré de réactions de complexation :
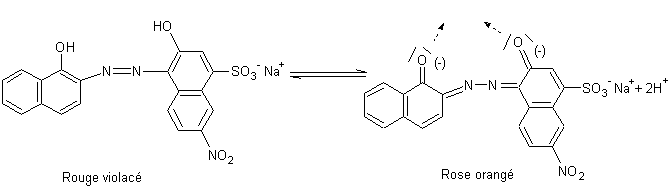
Désignons
par H2T le noir ériochrome T ; nous
avons écrit :
![]()
C’est
vrai pour pH > 12 (T2- est rose orangé).
En
pratique, l’indicateur est surtout utilisé à pH = 10 et dans ce cas :
![]()
Au
départ, en présence de cation M2+ :
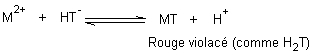
En
fin de dosage, les traces de M2+ qui avaient été captées sont
libérées :
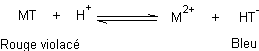
On
observe un virage du rouge violacé au bleu.
3) Les dérivés du triphénylméthane :
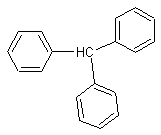
3-1) La fuchsine :
(du nom des chimistes industriels lyonnais, les frères Renard, la traduction du
mot « renard » en allemand étant Fuchs).
S’obtient
en oxydant par SnCl4 un mélange à parts égales d’aniline, d’o.et p.
toluidines. C’est un indicateur d’oxydo-réduction :
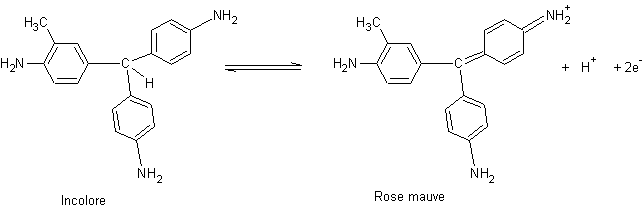
Application : réactif de Schiff pour la détection des
aldéhydes :
On
décolore la fuchsine par NaHSO3 (qui joue le rôle de réducteur et
qui déplace l’équilibre ci-dessus vers la gauche) et l’on obtient le réactif de
Schiff. Celui-ci est coloré en violet par les aldéhydes.
Interprétation : Les aldéhydes
se combinent à NaHSO3 (pour donner une « combinaison
bisulfitique ») ce qui entraîne une évolution vers la droite (équation
ci-dessus) ; on devrait retrouver la couleur rose mauve de départ, mais
les aldéhydes donnent en outre, une réaction de condensation avec les groupes
amine de la fuchsine :
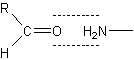
ce qui fait que la couleur obtenue n’est pas exactement la
couleur d’origine.
3-2) Le violet cristal
(ou violet de méthyle 10B, ou violet basique 3) :
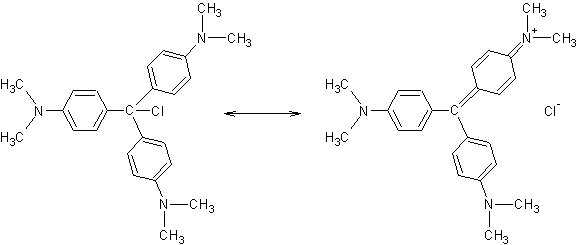
Remarque : On trouve
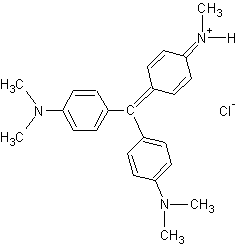
également le violet de méthyle 6B :
et le violet de méthyle 2B :
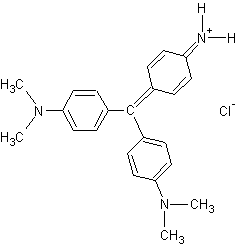
On
s’aperçoit que la couleur devient de plus en plus violette au fur et à mesure
que le nombre de groupes –CH3 augmente c'est-à-dire que le violet de
méthyle 10B est plus violet que le violet de méthyle 6B lui-même plus violet
que le violet de méthyle 2B. Le mélange de ces trois molécules correspond au
violet de gentiane utilisé en microbiologie pour la coloration de Gram.
3-3) Le bleu patenté V :
Colorant alimentaire répertorié sous le code E131, de couleur bleu cyan utilisé
dans les boissons.
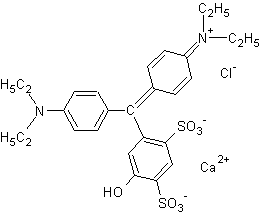
La
couleur verte du sirop de menthe du commerce est due à un mélange de tartrazine et de bleu patenté V.
3-4) Le vert acide
brillant (ou vert S) colorant alimentaire E 142 est une molécule
voisine :
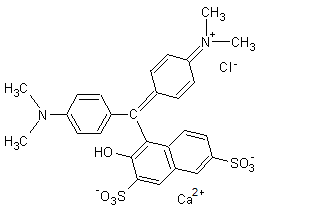
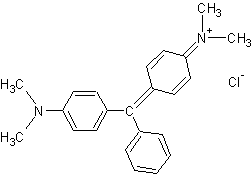
3-5) Le vert malachite :
très utilisé comme teinture
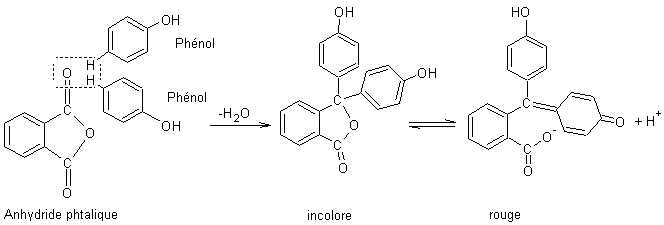
Ce
sont des produits de condensation de l’anhydride phtalique avec les phénols.
4-1) Phtaléine du phénol : c’est un
indicateur de pH
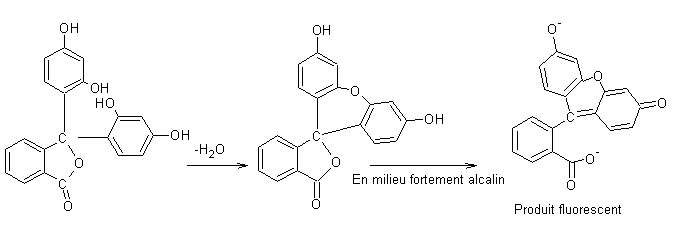
4-2) Fluorescéine :
En
remplaçant le phénol par le résorcinol, il se produit une condensation
supplémentaire et on obtient la fluorescéine ; c’est une poudre rouge qui
donne une coloration « vert fluorescent » en solution dans l’eau.
L’éosine est la tétrabromofluorescéine (antiseptique, colorant en
biologie). C’est un colorant rouge.
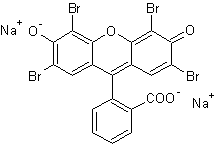
L’érythrosine est la tétraiodofluorescéine (colorant alimentaire E127). C’est un colorant rouge.
Le
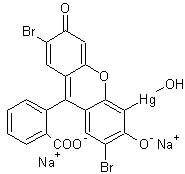
mercurochrome, un dérivé disodique de la dibromohydroxymercurifluorescéine, est un puissant
antiseptique de couleur rouge, qui n’est plus commercialisé en France depuis
2006 :
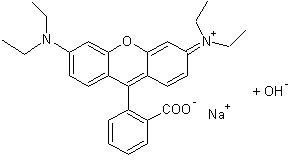
4-3) Les rhodamines sont
des phtaléines faites avec des m-aminophénols ;
elles teignent bien le coton et la soie en rouge.
Exemple :
4-4) Les sulfones
phtaléines :
L’anhydride
phtalique
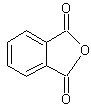
est remplacé par l'anhydride o-sulfobenzoïque
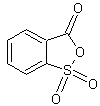
et si le phénol utilisé est l’α-bromothymol
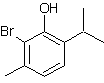
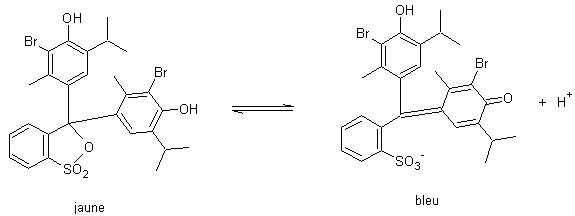
on obtient la dibromothymol sulfone
phtaléine qui est le bleu de bromothymol, un indicateur de
pH (0<pH< 6 jaune ;
7,6<pH<14 bleu)
5) Les colorants quinoniques :
Ce
sont des dérivés de la p-quinone :
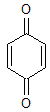
Quelques
exemples parmi les plus simples :
Le juglone
est
une molécule présente dans les feuilles et l’écorce du noyer (teinte
brune) ; elle possède des propriétés antifongiques et
antimicrobiennes :
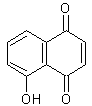
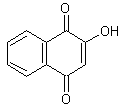
Le lawsone
est
le principal colorant contenu dans les feuilles de henné (Lawsonia inermis), arbuste de quelques mètres de
haut ; teinte brun-roux. Ce colorant sert surtout à teindre la peau et les
cheveux :
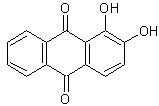
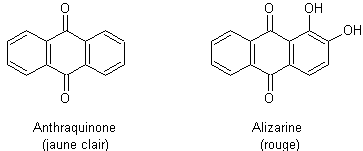
5-2) Anthraquinones :
-
L'alizarine
Pendant
des siècles on a produit des vêtements teints avec un colorant, tiré de la
racine de garance. La garance est une plante grimpante de la famille des rubiacés (Rubia tinctorium)
autrefois cultivée dans le sud de la France pour
en tirer cette substance colorante dont le principal produit organique
responsable de sa couleur est l'alizarine. Cette teinture est connue depuis
l’antiquité ; l’archéologue britannique Carter découvre des textiles
teints avec de la garance dans la tombe de Tout-Ankh-Amon (1330 environ
avant-J.C)).
|
|
alizarine |
|
L’alizarine
a été isolée de la garance pour la première fois, par Robiquet en 1826.
La synthèse de
l'alizarine réalisée en 1868 par Graebe et Liebermann
marqua la fin de la culture de la garance.
-
Disperse violet 1 (1,4-diaminoanthraquinone)
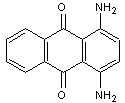
utilisé en teintures capillaires.
5-3) Quinones
imines :
Noyau
![]()
Par
action des p-phénylènediamines sur les phénols, on
obtient des composés tels que :
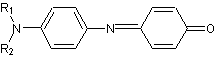
Avec
R1 et R2 représentés par –C2H5, on
a un colorant cyan utilisé en photographie.
6-1) L’indigo :
L’association
de deux molécules d’indoxyle avec déshydrogénation
conduit à l’indigo :
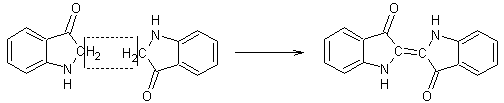
Cette
forme est colorée (remarquer le système de doubles liaisons conjuguées). La
teinte indigo est intermédiaire entre le bleu et le violet.
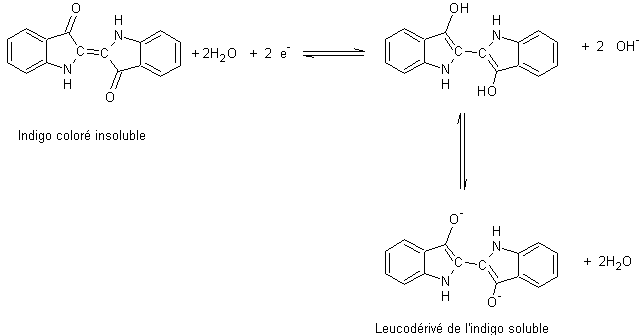
Il
est important de signaler la forme réduite, incolore, car c’est obligatoirement
sous cette forme, soluble, que le produit se fixe sur les fibres textiles
lorsqu’on l’utilise comme teinture.
L’indigo
existe à l’état naturel dans les feuilles de pastel (Isatis tinctoria, une crucifère) sous forme d’hétéroside (à base de fructose) et dans
les feuilles d’un arbuste des pays chauds, l’indigotier (Indigofera tinctoria , papilionacée)
sous forme d’un autre hétéroside (à base de glucose).
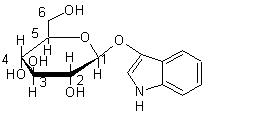
L’hétéroside
précurseur de l’indigo dans l’indigotier est l’indican ; le glucose est
sous forme de β-D-glucopyranose et c’est le –OH porté par C1
qui est mis en jeu.
L’hétéroside
précurseur de l’indigo dans le pastel est l’isatan
B ; le fructose est sous forme de β-D-fructofuranose
oxydé en C6 et c’est le –OH de ce carboxyle qui est mis en jeu.
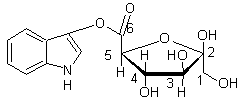
On
fait la synthèse de l’indigo :
·
à partir d’aniline et d’acide monochloracétique
ou
·
à partir d’α nitrobenzaldéhyde
et d’acétone.
Cette
molécule s'avéra très difficile à synthétiser ; A.Baeyer
mit dix ans pour en établir la constitution puis la synthétiser. C'est le
procédé de Karl Heumann (à partir d’aniline
et d’acide monochloracétique) qui fut adopté pour la
synthèse industrielle à grande échelle. C'est à partir de 1897 que l'indigo
artificiel remplaça l'indigo naturel.
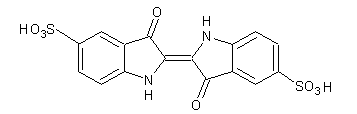
6-2) Le carmin
d’indigo : de couleur très voisine correspond à l’acide
5-5’disulfonique de l’indigo (ou à son sel de disodium).
C’est le colorant alimentaire référencé E132.
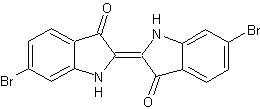
6-3) Indigoïdes
des pourpres et des murex : Certains gastéropodes (pourpres,
murex) fournissent le 6,6'-dibromoindigo dont les rouges étaient très prisés
dans l'Antiquité. On les trouve au bord des côtes, dans presque toutes les
parties du monde.
Le
colorant n'existe pas dans l'animal ; il y a un précurseur – comme pour les
plantes à indigo – et l'union de deux molécules en présence d'oxygène engendre
le colorant à la mort de l'animal.
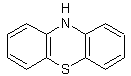
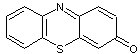
7) Les colorants aziniques :
Ils
renferment le noyau thiazine :
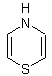
En
pratique on a à faire à la dibenzothiazine :
Un
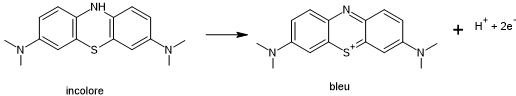
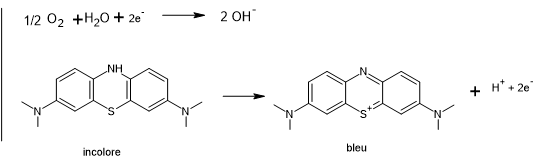
dérivé azoté bien connu est le bleu de méthylène :
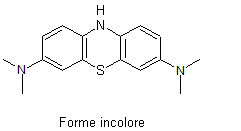
Le
produit se colore au contact de l’oxygène de l’air
Le
doublet de N-H resté sur N au départ de H+ bascule (par exemple à
droite).
Le
soufre (S) étant moins électronégatif que l’azote (N), le déplacement
d’électrons peut se poursuivre de la façon suivante :
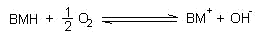
S
a normalement 6 électrons périphériques.
Ici
S passe par un stade où il a 7 électrons périphériques.
Les
2 électrons figurant dans l’équation fondamentale peuvent être des électrons
qui quittent le soufre. On note donc (S+) sur le cycle.
Remarque : le système de
doubles liaisons conjuguées, responsable de la couleur, forme un circuit fermé.
Si
l’oxydation met en jeu l’oxygène de l’air :
On
peut donc écrire :
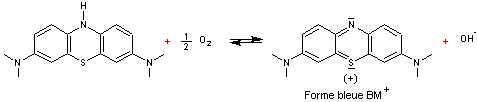
L’oxygène
peut remplacer le soufre et on a de la dibenzoxazine ou « phénoxazine »
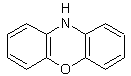
Une
formule calquée sur celle du bleu de méthylène donne le bleu
Capri :
La
dibenzoxazine est le noyau de base d’une formule
complexe correspondant au colorant appelé « tournesol »
qui s’obtient à partir de lichens à orseille, présents sur les rochers des mers
un peu chaudes comme la Méditerranée, mais aussi dans les montagnes.
Ce
groupe comprend les carotènes et les xantophylles.
Ils colorent en jaune, orange, exceptionnellement en rouge, la carotte, les
abricots, le maïs, la citrouille, le safran, les œufs, la crème de lait, les
crustacés cuits (rupture avec une protéine), les feuilles en automne, la
tomate, etc….
Ils
sont masqués par la chlorophylle dans les feuilles vertes.
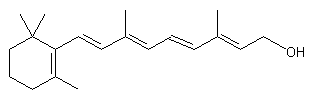
8-1) Les carotènes :
·
Un
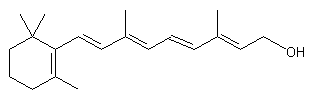
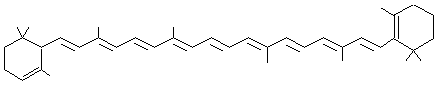
carotène très répandu : le β-carotène ; il possède 40
carbones et deux cycles identiques :
Il
est le précurseur de la vitamine A :
·
Il
existe un α-carotène :
Le
cycle de gauche est légèrement différent ; sa double liaison n’est pas
placée au même endroit.
·
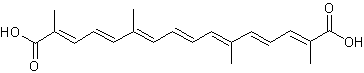
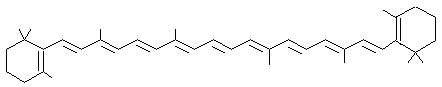
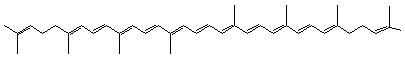
Enfin
on peut ajouter le lycopène, toujours en C 40 mais dépourvu de
cycle :
Les
carotènes sont rouges. La tomate renferme plus spécialement du lycopène.
8-2) Les xanthophylles (du grec xanthon = jaune
et phullon = feuille)
Ce
sont des pigments jaunes, dérivés oxygénés des carotènes :
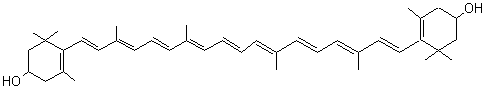
·
Zéaxanthine (zéa : pour
maïs)
Cette
molécule ressemble à celle du β-carotène ; un groupe hydroxyle (-OH)
remplace un hydrogène dans chacun des deux cycles.
·
Lutéine du latin luteum = jaune (nom)
Cette
molécule est présente dans de nombreux légumes à feuilles vertes (brocolis,
chou vert, épinards, petits pois, endives crues....)
mais aussi dans les algues vertes et rouges, le maïs, le jaune d'oeuf, le jus d'orange ; elle n’est pas synthétisée par
l'organisme. Son action antioxydante et son rôle de filtre de la lumière bleue,
semblent protéger des UV, certaines molécules sensibles des cellules végétales .
Dans l'organisme
humain elle semble avoir un rôle retardateur du vieillissement oculaire. On en
retrouve ainsi que la zéaxanthine au niveau de la macula; elle est surtout localisée dans les cellules
périphériques de celle-ci.
C'est un pigment
orangé.
Cette
molécule ressemble à celle de l’α-carotène ; un groupe hydroxyle
(-OH) remplace un hydrogène dans chacun des deux cycles.
·
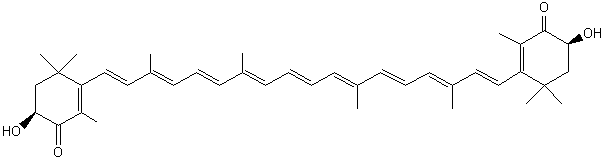
Astaxanthine
(en zoologie astacus
= écrevisse)
Cette
molécule existe naturellement chez les salmonidés, les crabes, les crevettes,
les homards et les langoustes, les langoustines, les écrevisses, en même temps
que d'autres caroténoïdes (canthaxanthine...).
A la cuisson, la protéine qui entoure l'astaxanthine
la libère et cette molécule donne à ces poissons et à ces crustacés une couleur
rose.
·
La crocétine :
Cette
molécule existe dans la fleur de safran (Crocus
sativus L.).
Les
noyaux suivants se retrouvent dans les colorants naturels que sont les flavones
et les anthocyanes :
|
|
|
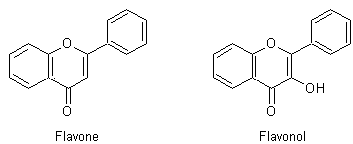
9-1) Les
flavones du latin flavus = jaune
(adjectif)
Ce
sont des pigments qui colorent les fleurs en jaune. Il en existe une grande
variété qui diffèrent par la nature et la place des substituants –OH et –OR sur
les noyaux.
Exemples :
·
La
lutéoline du latin luteum = jaune (nom) des fleurs
de réséda (reseda luteola)

·
La
quercétine du bois du chêne tinctorial (chêne quercitron)

9-2) Les
anthocyanes :
Les
anthocyanes forment une gamme très étendue de bleus et de rouges, colorant les
fleurs et les fruits. Les différences de substituants sur les noyaux, ne
suffisent pas à expliquer ces différences de teintes ; ces composés sont
très sensibles au pH.
Prenons
l’exemple de la cyanidine, extrêmement
répandue : bleuet, coquelicot, cerise, fraise, framboise,
….. :
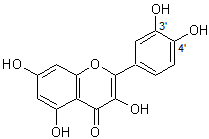
On comprend alors pourquoi elle donne une couleur bleue au
bleuet qui a une sève alcaline et une couleur rouge au coquelicot qui a une
sève acide.
Une fleur ou un fruit peut contenir un mélange d’anthocyanes.
Ainsi le géranium contient de la pelargonidine :
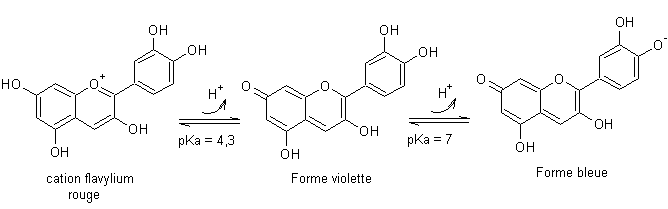
La fraise, elle, contient de la cyanidine
et de la pelargonidine.
10) Colorants dus à des complexes :
Citons
quelques exemples :
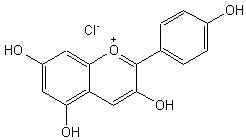
10-1) L’ion
cupritartrique (ou tartrate cuivrique ou ditartratocuivre(II))
bleu foncé est celui de la liqueur de Fehling :
En
enlevant un ion H+ à chaque OH des groupes carboxyles de l’acide
tartrique,
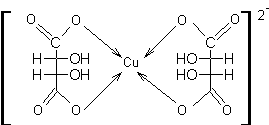
et l’un quelconque des trois doublets de l’oxygène peut être
cédé à Cu2+.
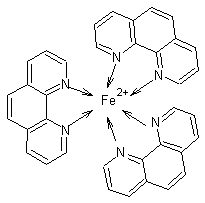
10-2) L’orthophénanthroline ferreuse : c’est
le tri(1,10-phénanthroline)fer II
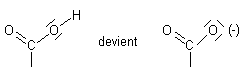
Ce
complexe de coloration rouge est stable dans un domaine de pH allant de 2 à 9.
Il permet un dosage spectrophotométrique des ions fer (II) dans le visible (510
nm).
On
peut également doser les ions Fe(II) complexés par l’orthophénanthroline, par les ions
dichromate, la demi-équation rédox des ions fer(II)
complexés étant :
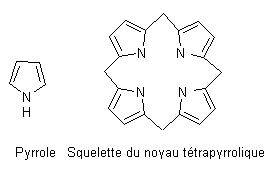
10-3) Colorants tétrapyrroliques :
Le
squelette fondamental est constitué de quatre noyaux pyrrole reliés en cycle,
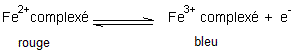
-
Le
noyau tétrapyrrolique est plan, il constitue (sans
atome métallique au centre) une structure dite porphyrine, il est alors
muni de chaînes latérales. Avec certains ions métalliques fixés au centre, on
obtient des colorants ; notamment deux colorants universellement
connus :
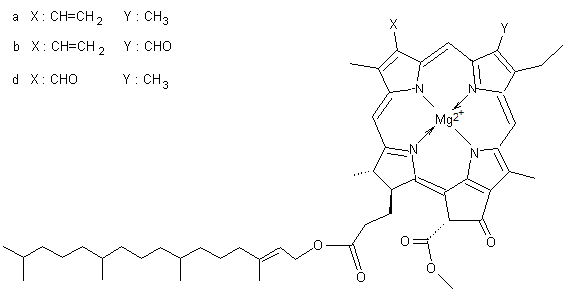
·
Mg2+ c’est la chlorophylle, pigment
vert ; grâce à lui, les plantes captent l’énergie lumineuse nécessaire à
l’élaboration des tissus végétaux.
Il
existe trois molécules de chlorophylle : a ou α (C55H72MgN4O5),
b ou β (C55H70MgN4O6), d ou d (C54H70MgN4O6).
Les
grains de chlorophylle, disséminés dans la cellule végétale sont appelés
« chloroplastes ».
·
Fe2+ C’est l’hémoglobine ; pigment de
couleur rouge.
L’hémoglobine
est constituée d’un noyau (hème), le pigment, associé à une protéine
(globine) ; la globine est entourée de quatre hèmes
:
Noyau
hème :
L’hémoglobine
est le pigment respiratoire des vertébrés ; c’est la nature de la globine
qui change suivant les espèces. Chez l’homme la globine est constituée de
quatre chaînes polypeptidiques, deux chaînes comprenant 141 acides aminés et
deux chaînes 146 acides aminés.
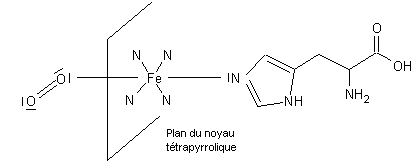
Dans
le transport d’oxygène, Fe2+ n’est pas oxydé en Fe3+, La
molécule O2 se fixe latéralement sur le fer, au milieu du cycle.
La
molécule CO, comparable, peut malheureusement se fixer à sa place dans
l’asphyxie à l’oxyde de carbone.
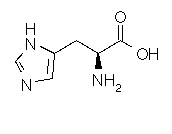
Remarque :
Le
pigment (noyau hème) est rattaché à la chaîne polypeptidique au niveau de l’un
de ses acides aminés, l’histidine :
Le
fer possède donc 6 liaisons ainsi que le montre le schéma suivant :
-
Si
sur le noyau tétrapyrrolique, les chaînes latérales
sont remplacées par des noyaux benzène, on a le noyau tétrabenzopyrrolique,
et si on intercale un atome d’azote sur les liaisons qui relient les 4 noyaux et que l’on
ajoute un ion cuivre (II) au centre, on obtient un pigment bleu : la
phtalocyanine au cuivre,
Ce
pigment organique bleu (cyan) appartenant à la famille des tétraazatétrabenzoporphyrines est utilisé
notamment pour les encres d’imprimerie ; on s’en sert également en peinture..
Cette molécule
peut être obtenue par condensation de 4 molécules de phtalonitrile:
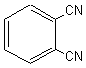
en présence de cuivre métal à 200°C.
Mais
sa préparation la plus courante fait intervenir de l’anhydride phtalique, de
l’urée et un oxyde métallique.
Remarque :
Il existe des pigments tétrapyrroliques linéaires (non cycliques). C’est le cas
des phycobilines :
phycocyanobiline
(bleue) et phycoérythrobiline (rouge) présentes
toutes les deux dans les rhodophycées (algues rouges) et dans les
cyanobactéries (anciennement "algues bleues") et participant à la
photosynthèse à côté de la chlorophylle.
Ces phytobilines
sont des groupements prosthétiques d'hétéroprotéines, les associations ainsi
réalisées portent le nom de phycocyanine et phycoérythrine.
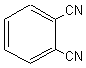
Formule de la phycocyanobiline :
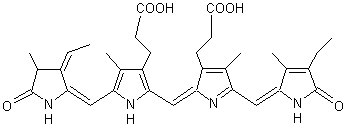
La
formule de la phycoérythrobiline ne différe de la précédente que par une légère modification au
niveau du quatrième noyau, à droite :
En
regroupant les colorants organiques en 10 classes, nous n’avons pas eu
l’occasion d’aborder des colorants parfois importants mais difficiles à classer
(cas isolés, molécules d’une grande complexité, …..)
11-1) Des rouges :
-
Le
rouge de betterave est de la bétacyanine,
hétéroside de la bétanidine :
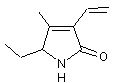
Il constitue environ 90% du colorant rouge de la
betterave (Beta vulgaris L.var.rubra). C’est un des rares colorants rouges
naturels qui n’est pas anthocyane. On trouve
également ce colorant dans la figue de barbarie.
C’est un colorant alimentaire noté E 162, qui est parfaitement
toléré par l’organisme (non toxique) et partiellement rejeté dans les urines.
- Colorants des « bois rouges :
Donnons deux exemples
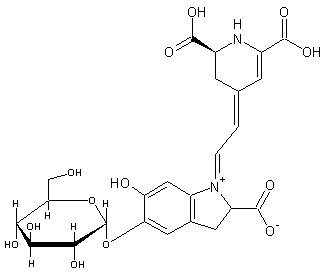
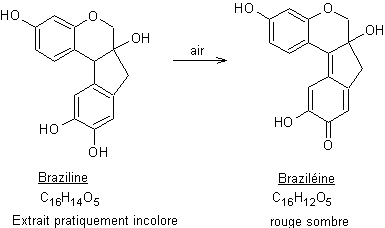
Molécules
qui se forment par oxydation spontanée à l'air, des substances majeures des
"bois rouges solubles" : bois du Brésil et notamment de Pernambouc,
bois de Campêche (la plus vieille ville espagnole connue du Yucatan au
Mexique). Les molécules extraites sont incolores et en quelques heures se
transforment en braziléine de couleur rouge foncé ou
en hématéine de couleur jaune puis rouge puis noire (voir colorants noirs).
Elles servaient autrefois à fabriquer les laques rouges utilisées par les
artistes peintres.
Ces bois qui
donnaient des substances de couleur braise sont à l'origine du nom du pays
Brésil.
Le bois de Santal doit sa couleur rouge à un mélange de
substances de formules apparentées aux précédentes, mais plus complexes : les
santalines et les santarubines.
Le bois de Campêche appelé aussi campêche est un bois lourd et dur, riche en tanins, arbre du genre Hematoxylum (césalpiniacées).
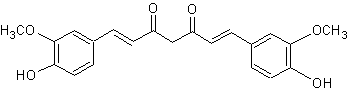
11-2) Des jaunes :
-
L’acide picrique :
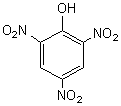
est un colorant jaune, très important en teinture.
-
La curcumine :
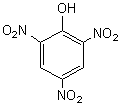
issue du rhizome du curcuma. C’est le colorant
alimentaire E100.
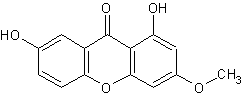
-
La gentisine :
C'est
une xanthone qu'on peut extraire de la racine de gentiane jaune (Gentiana lutea)
appelée aussi grande gentiane ou gentiane d'or que l'on trouve notamment en
Auvergne et dont on utilise la racine pour fabriquer des boissons alcoolisées
(Suze, Avèze …).
11-3) Des noirs :
Les
teintes noires sont d’origines diverses :
-
L’aniline sous l’effet
d’oxydants (ClO3-, Cr2O72-…) donne
de beaux « noirs d’aniline ».
Une
des structures possibles :
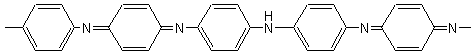
Une autre
structure avancée:
Pour teindre les
vêtements on imprègne la fibre d'une solution chlorhydrique d'aniline puis on
oxyde avec du chlorate de sodium ou de potassium, et finalement avec du
dichromate de sodium.
-
L’hématoxyline dont la formule a été donnée ci-dessus (colorants rouges) peut s’oxyder à l’air pour donner de
l’hématéine de couleur noire.
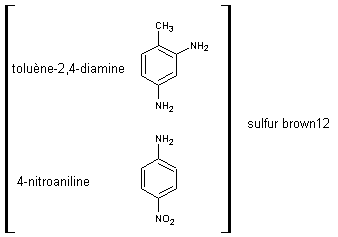
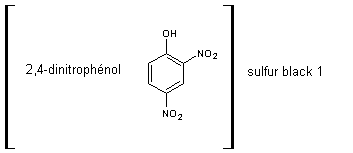
11-4) Colorants
au soufre :
Ce
sont des matières colorantes obtenues par chauffage de composés à noyau benzène
diversement substitués (amines, dérivés nitrés, phénols, ….)
ou de composés hétérocycliques le plus souvent azotés en présence de soufre ou
de polysulfures alcalins.
On
peut obtenir diverses teintes : noir, brun, rouge sombre, jaune, ….
La
structure des colorants obtenus est généralement encore mal connue. Il peut y
avoir des atomes de soufre dans des noyaux, par exemple
|
les noyaux thiazole |
et dibenzothiazinone |
|
|
|
ou dans des chaînes comme R-S-S-R'.
C'est
pourquoi ces produits sont désignés en citant les molécules qui ont servi de
point de départ.
11-5) Des
polyphénols :
Les
polyphénols sous forme de tanins,
donnent des beiges, des marrons, des gris, des noirs.
Donnons
comme exemple de pigment naturel polyphénol, le gossypol,
qui a un rôle biologique.
C’est un pigment jaune, extrait de
la graine du cotonnier (Gossypium – Malvaceae).
Cette molécule est un inhibiteur de plusieurs enzymes déshydrogénase. Des
recherches sur ses propriétés contraceptives (masculines) ont été faites en
Chine. On l’a longtemps utilisé contre la malaria.