ANTHOCYANES
OU ANTHOCYANINES
Les anthocyanes
sont des hétérosides oxygénés (un ou plusieurs
oses ( glucose, galactose, rhamnose, arabinose) liés par leur fonction
réductrice à une molécule non glucidique dite aglycone) dont la partie
aglycone est appelée anthocyanidine. On peut aussi en ne les rattachant
qu'à leur partie aglycone, les qualifier de flavonoïdes.
Les anthocyanes sont
les matières colorantes des feuilles, des fleurs, des fruits et des racines de
beaucoup de plantes terrestres (ce sont des pigments notamment présents dans
les feuilles de vigne, la pellicule des raisins noirs, la pulpe des cépages
teinturiers mais aussi dans les mûres, les prunes, les oeillets....). ; en
automne, les couleurs caractéristiques des feuilles des arbres sont dues aux
anthocyanes et aux carotènes qui ne
sont plus masqués par la chlorophylle.

Les anthocyanidines (encore appelées
anthocyanidols) ont pour structure de base l'ion flavylium :
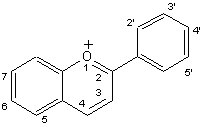
Les principales anthocyanidines sont
:
- La pélargonidine(Chlorure de) :
 Orangé à pH<1
Orangé à pH<1
|
Position 3' |
Position 5' |
|
H |
H |
- La cyanidine(Chlorure de) :
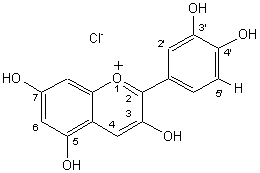 Orangé rouge à pH<1
Orangé rouge à pH<1
|
Position 3' |
Position 5' |
|
OH |
H |
- La malvidine(Chlorure de) :
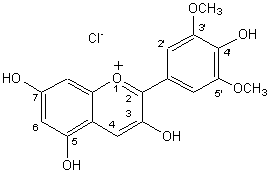 Violet à pH<1
Violet à pH<1
|
Position 3' |
Position 5' |
|
OCH3 |
OCH3 |
- La paeonidine(Chlorure de) :
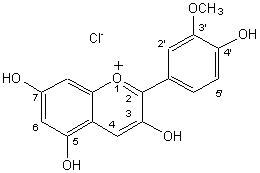 Rouge à pH<1
Rouge à pH<1
|
Position 3' |
Position 5' |
|
OCH3 |
H |
- La delphinidine(Chlorure de) :
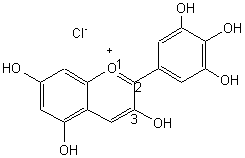 Violet à pH<1
Violet à pH<1
|
Position 3' |
Position 5' |
|
OH |
OH |
- La pétunidine(Chlorure de) :
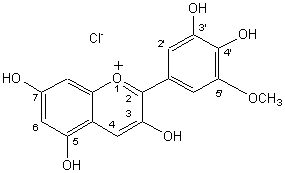
|
Position 3' |
Position 5' |
|
OH |
OCH3 |
Les anthocyanes sont faiblement
solubles dans l'eau froide ; leur couleur varie du rouge au bleu selon le pH ;
le schéma ci-dessous résume les transformations des anthocyanidines liées aux
modifications de l'acidité du milieu :
Malgré leur pouvoir colorant, les
anthocyanes sont peu utilisées dans les industries alimentaires et cosmétiques,
et ceci du fait de leur instabilité (perte ou changement de couleur) à la lumière,
lors d'une variation de température et d'un changement de pH, ainsi que de
réactions avec le dioxyde de soufre utilisé comme agent conservateur des
aliments, de leur faible solubilité dans l'eau et d'une possible précipitation
d'anthocyanes sous forme de complexes avec les protéines.
