TERPENES
Plan de l’étude :
2)
Les hydrocarbures terpéniques
3)
Les composés terpéniques oxygénés
6-1) Acide
mévalonique – HMG-CoA
6-2) Schéma
général de synthèse des terpènes
6-2-1) Biosynthèse des monoterpènes à partir du diphosphate de
géranyle (GPP)
6-2-2) Biosynthèse des sesquiterpènes à partir du diphosphate de
farnésyle (FPP)
6-2-3) Biosynthèse des triterpènes à partir du diphosphate de
farnésyle (FPP)
6-2-4) Biosynthèse des diterpènes à partir du diphosphate de
digéranyle (GGPP)
6-2-5) Biosynthèse des tétraterpènes à partir du diphosphate de
digéranyle (GGPP)
1)
Définition –Utilisation :
Le nom vient du mot allemand Terpen (1866) provenant de das Terpentin : la térébenthine. L'emprunt francisé terpène date de la fin du XIXème siècle (1871).
Au sens strict, les terpènes sont des hydrocarbures
mais de nombreux dérivés (alcools,aldéhydes,cétones, acides), de structure
apparentée, sont considérés comme des composés terpéniques.
Ils sont présents, dans les végétaux, dont
ils sont souvent les constituants "de senteur" (térébenthine,camphre,
menthol, citronelle) ; on les extrait sous forme d'huiles essentielles pour la
parfumerie.
Certains
d'entre eux ont un rôle biologique important (hormones, vitamines …).
2) Les hydrocarbures terpéniques :
-Formule brute :
La formule moléculaire générale est (C5H8)n
avec
n = 1 l'isoprène
n = 2 C10H16
monoterpènes
n = 3 C15H24 sesquiterpènes
n = 4 C20H32
diterpènes
n
= 5 C25H40
sesterterpènes
n
= 6 C30H48 triterpènes
n = 8 C40H64 tétraterpènes
- structure :
Certains ont une structure acyclique;
ils comportent un nombre de doubles liaisons correspondant à leur
formule moléculaire 3 pour C10H16 ; 5 pour
C20H32 ; 7 pour C30H48.
D'autres ont un
ou plusieurs cycles soit un nombre plus réduit de doubles liaisons ; par
exemple pour C10H16 un cycle et 2 doubles liaisons ou
2 cycles et une double liaison.
3) Les composés terpéniques oxygénés :
Leurs chaînes carbonées sont analogues à celles des hydrocarbures acycliques correspondants mais avec souvent une insaturation moindre; exemple: le menthol, C10H19OH est monocyclique et saturé; il possède le même squelette que le limonène C10H16 monocyclique et possédant 2 doubles liaisons.
On peut du point de vue structure, les
considérer comme des polymères de l'isoprène
(2-méthylbuta-1,3-diène)
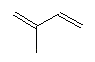
On peut en
effet, toujours "découper" en "motifs isoprènes" la formule
d'un terpène: 2 motifs pour un monoterpène, 3 pour un sesquiterpène, 8
pour un tétraterpène ;
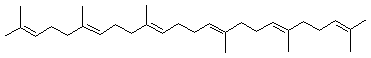
exemple: Ocimène (présent
dans le basilic)
![]()
5) Quelques
terpènes :
- Monoterpènes
|
|
|
|
|
|
Ocimène (basilic) |
Limonène
(citron, pin, menthe) |
a-pinène
(pin) |
b-pinène
(pin) |
|
|
|
|
|
|
(-) Menthol (menthe) |
l-Menthone
(menthe) |
Terpinéol
(lilas) |
Isobornéol
(pin) |
|
|
|
|
|
|
Camphre |
Nérol (rose,
géranium) |
Citronellal
(citronelle) |
Citronellol (rose) |
|
|
|
|
|
|
Myrcène (laurier) |
Myrcénol
(citron) |
Linalol
(muguet) |
Géraniol
(rose) |
-diterpène
|
|
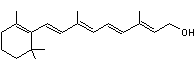
|
Vitamine A |
6) Biosynthèse
des terpènes :
La biosynthèse des terpènes suit la
voie de l'acide mévalonique, ce qui signifie qu'elle se différencie de certaines
autres biosynthèses à partir de l'acide mévalonique dans le schéma général des
biosynthèses (voie métabolique dite de l'HMG-CoA).
6-1)
Acide
mévalonique – HMG-CoA
Formule de l'acide mévalonique
![]()
C'est un composé important en
synthèse biochimique, un précurseur (sous la forme mévalonate) des terpènes et
des stéroïdes dans la voie métabolique dite de l'HMG-CoA.
Le point de départ de la synthèse de
l'acide mévalonique est l'acide éthanoïque.
Cet acide est activé par le coenzyme
A sous forme d'un thioester l'acétylcoenzyme A.

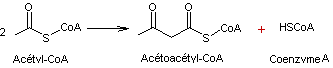
La suite de la synthèse :
- 1 –
|
|
Réaction catalysée par l'enzyme
Acétyl-CoA C-acétyltransférase
- 2 –
|
|
Réaction catalysée par l'HMG-CoA
synthase
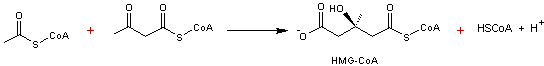
Il s'agit de l'addition du radical
acétyle de l'acétyl-CoA sur la fonction cétone de l'acétoacétyl-CoA par une
réaction de type cétolisation suivie d'une hydrolyse qui permet le départ du
coenzyme A.
- 3 –
|
|
Réaction catalysée par l'HMG-CoA
réductase un enzyme clé
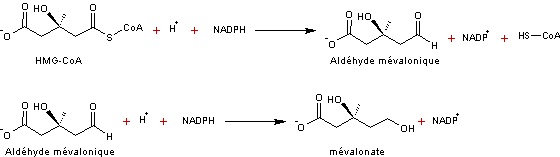
Remarque :
Afin de simplifier l'écriture de ces
réactions biochimiques, on adopte de nouveaux symboles (flèches courbes) pour désigner
les groupes ou molécules entrants et les groupes ou molécules sortants.
Ainsi, les équations chimiques de la
troisième étape, le passage de HMG-CoA au mévalonate s'écrivent :
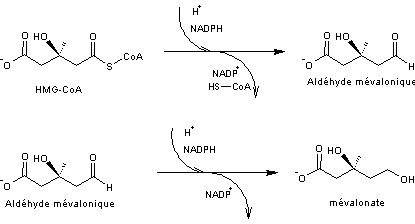
6-2) Schéma
général de synthèse des
terpènes :
A partir de l'acide mévalonique on
passe à une unité isoprène par phosphorylation des 2 groupes alcool de l’acide
mévalonique (grâce à l’ATP) puis par élimination d’eau avec formation d’une
double liaison C=C, puis par décarboxylation (-CO2), l’ensemble
conduisant au 3-méthylbut-3-ènylpyrophosphate appelé aussi diphosphate
d'isopentényle et abrégé en IPP
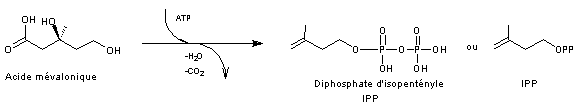
Il y a ensuite isomérisation de
l'IPP grâce à l'isopentényle diphosphate isomérase qui conduit au diphosphate
de diméthylallyle ou DMAPP :
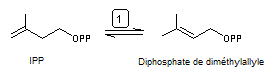
puis une succession de réactions conduisant
aux différentes familles auxquelles on s'intéresse :
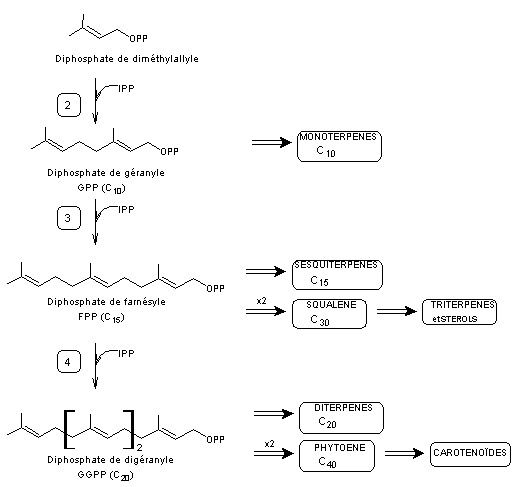
Les enzymes qui interviennent aux
premières étapes :
-
2 – Géranyldiphosphate synthétase
-
3 – Farnésyldiphosphate synthétase
-
4 - Géranylgéranyldiphosphate synthétase
6-3-1) Biosynthèse des monoterpènes à partir du diphosphate de géranyle (GPP)
- Monoterpènes
acycliques
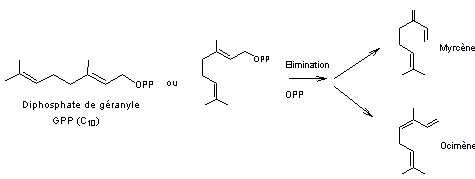
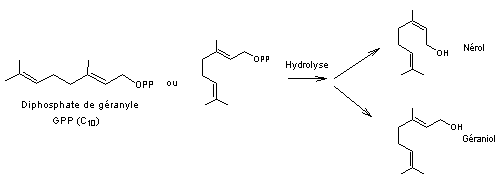
- Monoterpènes
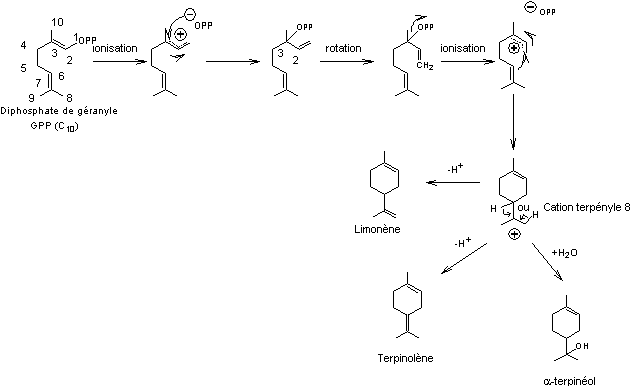
cycliques
Formation du limonène, du
terpinolène, de l'α-terpinéol
Un exemple de synthèse d'un
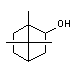
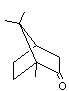
monoterpène bicyclique à partir du GPP : le camphre

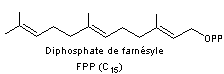
6-2-2) Biosynthèse
des sesquiterpènes à partir du diphosphate de farnésyle (FPP)
- Sesquiterpènes
acycliques
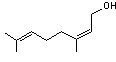
Exemple de la biosynthèse des
farnesols.
Le farnesol est un alcool
sesquiterpénique (2 isomères). C'est l'une des substances les plus répandues
dans le règne végétal à l'odeur de muguet.
Le 2-trans,6-trans-farnesol (E,E-farnesol) agit comme une hormone sur certains
insectes. Il intervient dans la métamorphose de la chenille au papillon.
ou
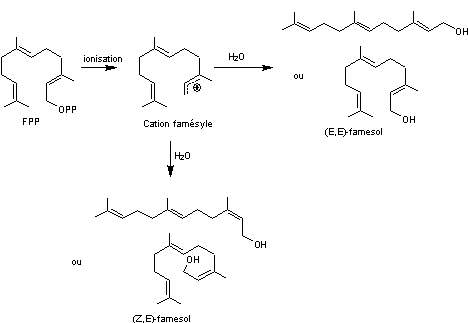
La formule moléculaire des farnesols
est C15H26O.
- Sesquiterpènes
cycliques
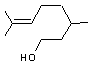
Exemple de la biosynthèse du
bisabolol.
Le
composé racémique se trouve à l'état naturel dans l'huile de bergamote et est
utilisé en cosmétique.
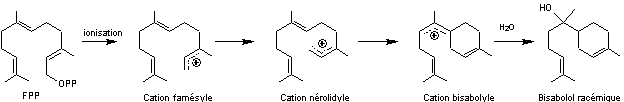
La formule moléculaire du bisabolol
est C15H26O.
6-2-3) Biosynthèse des triterpènes à partir du diphosphate
de farnésyle (FPP)
- Triterpènes
acycliques
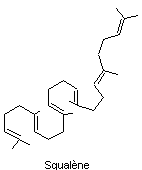
Exemple de la biosynthèse du
squalène
Il contient comme tous les
triterpènes 6 unités isoprène c'est un hydrocarbure en C30. C'est un
précurseur métabolique des stérols
Son nom vient de ce qu'on en trouve dans le foie de requin.
J.W.Cornforth le
synthétise la première fois à partir de l'acide mévalonique.
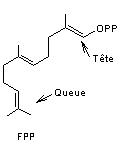
Deux molécules de pyrophosphate de
farnésyl ou diphosphate de farnésyle (FPP) peuvent s'unir lors d'un couplage
tête à tête
en milieu réducteur pour donner le
squalène

Le mécanisme :
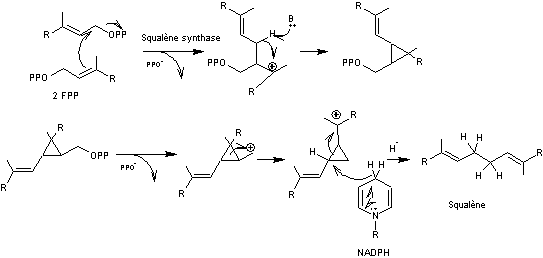
On peut présenter différemment le
squalène dans l'espace par rotation autour des simples liaisons C-C :
|
|
ou encore |
|
La formule moléculaire du squalène
est C30H50.
- Triterpènes
cycliques
On prendra l'exemple du lanostérol
qui est un alcool terpénique.
Le lanostérol est un triterpène tétracyclique duquel tous les stéroïdes
sont dérivés.
C’est aussi un des constituants du
suint de mouton (Le suint est la graisse qui imprègne la toison des moutons
dans le poids de laquelle elle entre pour 25 à 60% selon les races).
Le nom lanostérol est donc dérivé du
latin lana (laine).
Le point de départ de cette
biosynthèse est le squalène
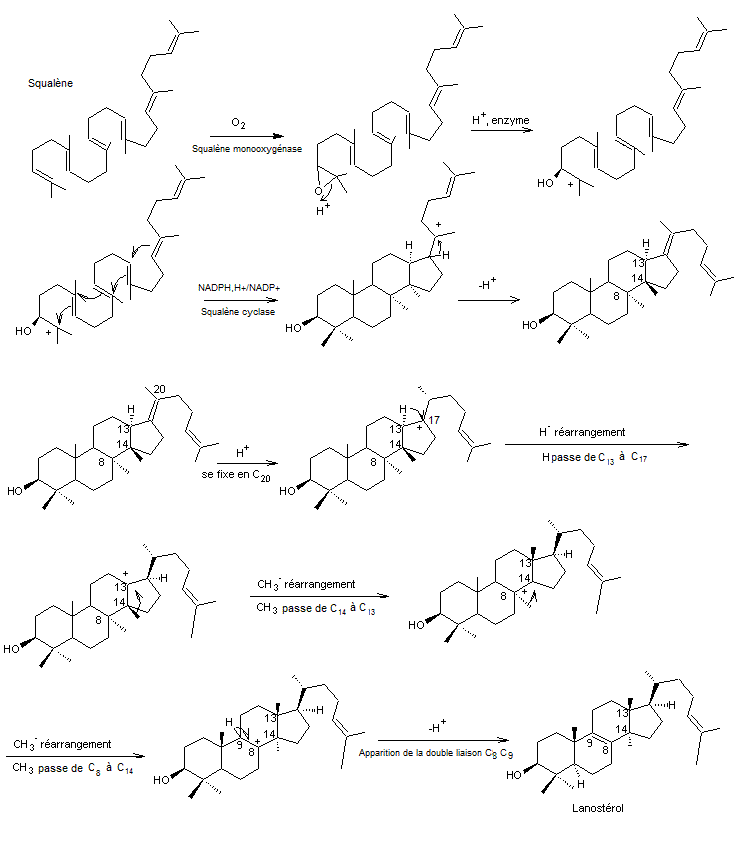
Le lanostérol ou Lanosta-8-24-dièn-3-ol, (3β) a pour formule
moléculaire C30H50O
6-2-4) Biosynthèse des diterpènes à partir du diphosphate
de digéranyle (GGPP)
- Diterpènes
acycliques
On prendra l'exemple du phytol
Composé oxygéné que l'on trouve sous
forme estérifiée dans la structure de la chlorophylle, on le retrouve donc
comme produit de dégradation de celle-ci.
Sa synthèse fut menée pour la
première fois par Franz Gottwald Fischer, en 1928.
Sa biosynthèse a lieu à partir du
diphosphate de digéranyle (GGPP) qui subit trois réductions par le
couple NADP+/NADPH puis une hydrolyse :
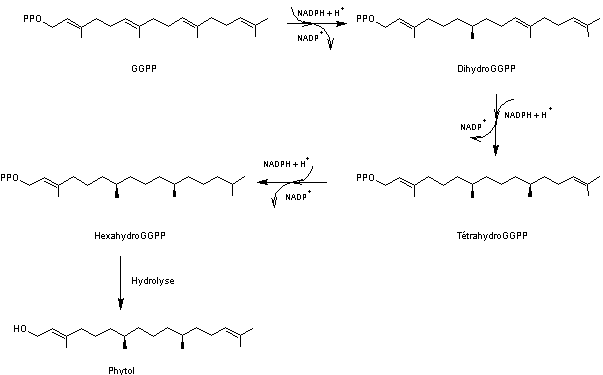
Le phytol ou
3,7,11,15,-tétraméthylhexadéc-2-èn-1-ol a comme formule moléculaire C20H40O.
- Diterpènes
cycliques
On prendra l'exemple du labdane :
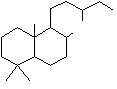
c'est un diterpène dont la structure
se retrouve dans de nombreux composés naturels.
Ainsi dans la résine sandaraque, une
résine commune exsudée d'un conifère Tetraclinis articulata qui a été
utilisée du XIIème au XVème siècle comme vernis alcoolique (dissoute dans de
l'huile de lin et de l'alcool) puis de nouveau au XVIIème siècle et au XVIIIème
comme vernis maigre dans la peinture d'art, on retrouve l'acide
agathique :
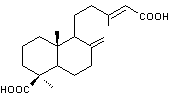
ayant une structure comportant un
noyau labdane.
La biosynthèse du labdane à partir
du diphosphate de digéranyle (GGPP) est la suivante :
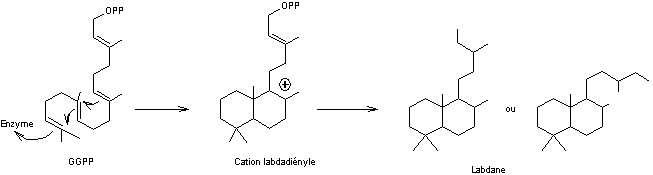
La formule moléculaire du labdane
est C20H38.
6-2-5) Biosynthèse
des tétraterpènes à partir du diphosphate de digéranyle (GGPP)
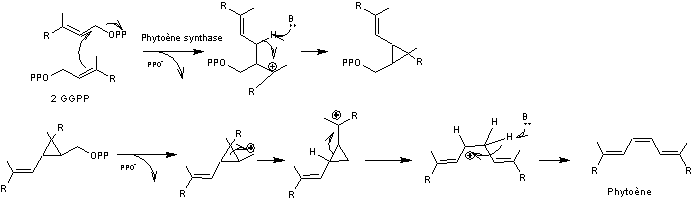
On prendra l'exemple du phytoène
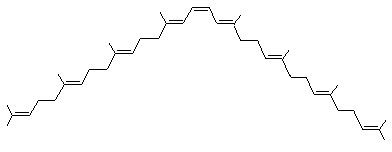
La biosynthèse s'effectue à partir
de deux molécules de diphosphate de digéranyle.
Les premières étapes du mécanisme
sont celles rencontrées lors de la biosynthèse du squalène :
La biosynthèse s'effectue à partir
de deux molécules de diphosphate de digéranyle.
Les premières étapes du mécanisme
sont celles rencontrées lors de la biosynthèse du squalène :