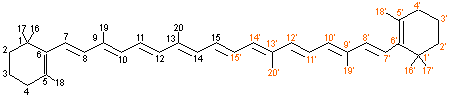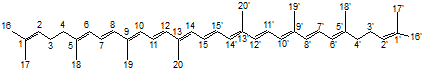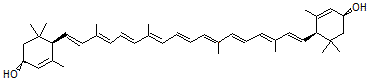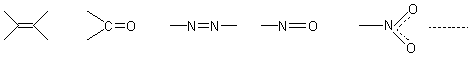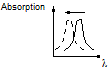LES CAROTENOÏDES
Gérard GOMEZ
Plan de l'étude
1-1)
Les carotènes
1-1-1)
Des carotènes alicycliques
1-1-2)
Des carotènes aliphatiques
1-2)
Des xanthophylles
1-3)
Les couleurs des caroténoïdes
1-4)
La biosynthèse des caroténoïdes
1-4-1)
De l'acide mévalonique au phytoène
1-4-2)
Du phytoène au lycopène
1-4-3)
Du lycopène aux carotènes alicycliques
1-4-4)
Des carotènes alicycliques aux xanthophylles
1-5)
Quelques propriétés des caroténoïdes
1-5-1)
Certains conduisent à la vitamine A
1-5-2)
Ils interviennent dans la synthèse chlorophyllienne
1-5-3)
Ils ont des propriétés anti-oxydantes
Les
caroténoïdes sont pour la plupart des pigments, constitués d'une longue chaîne
d'hydrocarbures polyènes ou de leurs dérivés oxygénés dont le groupe chromophore
(voir annexe 1) est fait de doubles liaisons C=C
conjuguées.
Une
majorité d'entre eux a huit résidus isoprène, donc 40 atomes de carbone ; ils
font partie des isoprénoïdes et on peut les rattacher aux tétraterpénoïdes.
Parmi
eux on peut distinguer les carotènes qui sont les hydrocarbures, et les
xanthophylles qui sont les dérivés oxygénés.
Dans
les végétaux, on trouve des caroténoïdes notamment dans les tissus verts
photosynthétiques, mais aussi dans les racines, les fruits, les graines et les
fleurs.
Les
animaux sont incapables de les synthétiser ; seule une absorption alimentaire
explique leur présence notamment chez les crustacés, les poissons, les oiseaux
et certains insectes.
On peut
diviser ces hydrocarbures en deux groupes, les alicycliques comme les α,
β, γ, d,
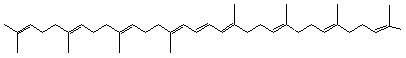
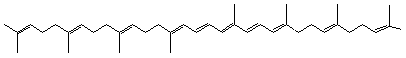
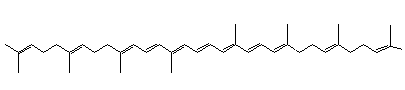
ε carotènes et les aliphatiques, par exemple le lycopène ou le
ζ-carotène.
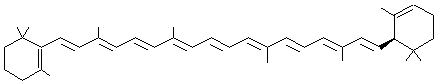
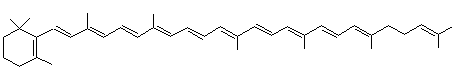
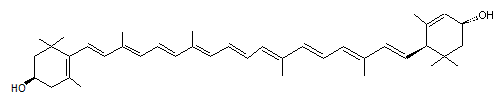
1-1-1) Des carotènes alicycliques
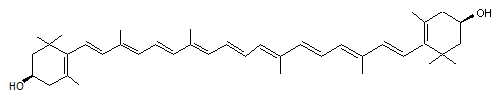
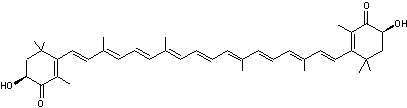
|
alpha
carotène ou β,ε-carotène Bêta,
epsilon-carotène C40H56 Masse
molaire 536,873
g.mol-1 Aspect Cristaux
en plaques rouges Fusion 187,5°C Densité 1,00 (20°C) Solubilité Très
soluble dans le benzène, l'éther, le chloroforme. N°
CAS 7488-99-5 |
Les
deux cycles terminaux de la chaîne sont différents ; celui de gauche est
appelé β et celui de droite ε. On
peut donc appeler l'α-carotène : le β, ε-carotène. |
Ce
pigment jaune orangé constitue environ 15% des hydrocarbures des carottes. |
|
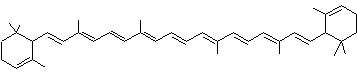
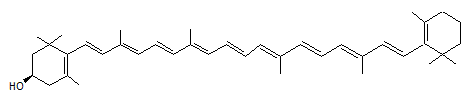
bêta
carotène ou β,β–carotène Bêta,bêta
carotène C40H56 Masse
molaire 536,873
g.mol-1 Aspect Prismes
hexagonaux rouge brun Fusion 183°C Densité 1,00 (20°C) Solubilité Soluble
dans le benzène, l'acétone, l'éther. Légèrement
soluble dans l'éthanol et le chloroforme. Insoluble
dans l'eau. N°
CAS 7235-40-7 |
Les
deux cycles terminaux de la chaîne sont identiques et appelés β. On
peut donc appeler le β-carotène : le β, β–carotène.
Numérotation des carbones |
Pigment
jaune-orangé. Parmi
les autres légumes qui en contiennent : Choux,
épinards, persil, poivrons…. On en
trouve aussi dans le jaune d'œuf … |
|
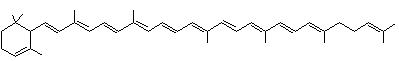
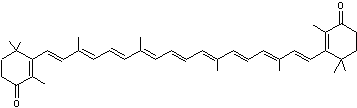
epsilon-carotène ou ε,ε–carotène Epsilon,epsilon
carotène C40H56 Masse
molaire 536,873
g.mol-1 N°
CAS 38894-81-4 |
Les
deux cycles terminaux de la chaîne sont identiques et appelés ε. On
peut donc appeler le ε -carotène : le ε,ε–carotène. |
On trouve ce composé à l'état naturel dans plusieurs
légumes : - Psophocarpus tetragonolobus c'est le
haricot ailé ou haricot dragon. - Flammulina velutipes C'est le collybie à pied velouté, un champignon
comestible dont le Japon fournit 80% de la production mondiale ; il est aussi
cultivé en Chine et en Corée. - Les fèves de la famille des fabacées. |
|
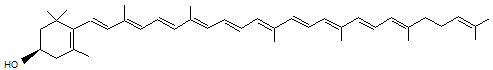
gamma
carotène ou β,ψ-carotène Bêta,psi
carotène C40H56 Masse molaire 536,873 g.mol-1 Aspect Prismes rouges (si recristallisé
dans benzène-méthanol) ; prismes violets (si recristallisé dans l'éther). Fusion 153°C Solubilité Soluble dans le benzène, le
chloroforme. Légèrement soluble dans l'éther et
l'éther de pétrole. Insoluble dans l'eau et l'éthanol. N° CAS 472-93-5 |
Cette
molécule n'a qu'un cycle β à une extrémité. L'autre extrémité non
cyclique est dite ψ. On
peut donc appeler le γ-carotène : le β,ψ-carotène. |
Pigment
jaune orangé constituant environ 0,1% des hydrocarbures des carottes. |
|
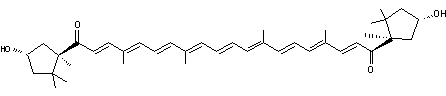
d-carotène delta
carotène ou ε,ψ-carotène Epsilon,psi
carotène C40H56 Masse
molaire 536,873
g.mol-1 N° CAS 472-92-4 |
Cette
molécule n'a qu'un cycle ε à une extrémité. L'autre extrémité non
cyclique est dite ψ. On
peut donc appeler le d-carotène
: le ε,ψ-carotène. |
Carotène
liposoluble, apparaissant dans la synthèse des plantes photosynthétiques
entre le lycopène et l'α-carotène ou l'ε-carotène. |
Toutes
ces molécules ont comme formule C40H56 , ce sont des
isomères, formes cycliques du lycopène présenté en 1-1-2.
Seuls
les carotènes α et β apparaissent dans les feuilles vertes.
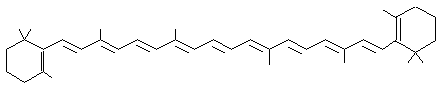
1-1-2) Des carotènes aliphatiques
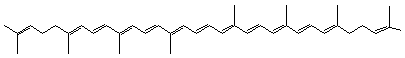
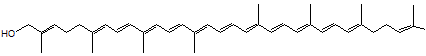
|
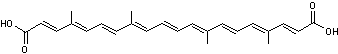
Lycopène ou Trans-lycopène ou ψ,ψ-carotène Psi,psi-carotène C40H56 Aspect Aiguilles
ou cristaux prismatiques rouges si recristallisé dans l'éther de pétrole. Masse
molaire 536,873
g.mol-1 Fusion 175°C Solubilité Très
soluble dans le benzène, le chloroforme et le sulfure de carbone ; soluble
dans l'éther ; légèrement soluble dans l'éthanol et l'éther de pétrole. N°
CAS 502-65-8 |
13
doubles liaisons (dont 11 conjuguées)
Numérotation
des carbones La numérotation "trans"
(ou E) se perçoit au niveau de la double liaison 15=15' |
Comme
les carotènes alicycliques il a comme formule C40H56
mais sa structure est linéaire. Il
donne à la tomate sa couleur rouge. On le trouve aussi dans l'abricot,
l'orange, le pamplemousse, la pastèque ... |
|
C40H64 Aspect Incolore,
absorbe dans l'UV à 287 nm. Masse
molaire 544,936
g.mol-1 N°
CAS 13920-14-4 |
9
doubles liaisons (dont 3 conjuguées) L'isomère 15 (Z) (isomère
représenté ci-dessous) a été isolé de plants de tomates.
|
Molécule
intermédiaire dans la synthèse des caroténoïdes chez les plantes. C'est
un tétraterpène, présent dans la majorité des fruits et des légumes. Composé
utilisé en dermocosmétique. |
|
C40H62 Aspect Il
absorbe dans les UVA à 348 nm. Masse
molaire 542,920
g.mol-1 N°
CAS 27664-65-9 |
10
doubles liaisons (dont 5 conjuguées) Isomère 15 (Z)
|
Caroténoïde
incolore présent dans divers légumes et fruits dont la tomate. |
|
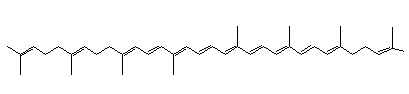
zeta
carotène C40H60 Masse
molaire 540,920
g.mol-1 N°
CAS 72746-33-9 |
11
doubles liaisons (dont 7 conjuguées) |
Sa
structure se rapproche de celle du lycopène mais la molécule comporte 4
hydrogènes supplémentaires (C40H60) sur les carbones
7-8, 7'-8'. |
|
C40H58 Masse molaire 538,904 g.mol-1 N° CAS 502-64-7 |
12 doubles liaisons (dont 9 conjuguées) |
Pigment
caroténoïde majoritaire dans Cantharellus infundibuliformis. C'est un
intermédiaire dans la biosynthèse du lycopène et d'autres caroténoïdes
bactériens. |
Les
xanthophylles sont des pigments jaunes ou jaunes-orangés constitués par des
dérivés oxygénés de carotènes.
|
ou β,ε–carotène-3,3'-diol,
(3R,3'R, 6'R) C40H56O2 Prismes
jaunes ou violets Couleur: 568,872g.mol-1 Fusion 196°C N°
CAS 127-40-2 |
|
Cette
molécule est présente dans de nombreux
légumes à feuilles vertes (brocolis, chou vert, épinards, potiron, petits
pois, endives crues....) mais aussi dans les algues vertes et rouges, le
maïs, le jaune d'oeuf. Son action antioxydante et son rôle de filtre de la
lumière bleue, semblent protéger des UV, certaines molécules sensibles des
cellules végétales. colorant
alimentaire sous le code E161b |
||
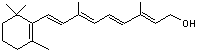
|
ou β,β–carotène-3-ol
(3R) C40H56O Aspect : Cristaux
prismatiques rouges grenat Masse
molaire
: 552,872
g.mol-1 Fusion : 160°C Solubilité : Très
soluble dans le chloroforme, le benzène. N°
CAS
: 472-70-8 |
|
Pigment
dont la molécule est proche de celle du β-carotène
; il est converti dans l'organisme humain en vitamine A (c'est donc une
provitamine A). C'est
un antioxydant. On en
trouve dans les poivrons, les courges, les pommes, le zeste d'orange, le jaune d'œuf, le beurre … C'est
aussi un colorant alimentaire répertorié avec le code E161c. |
||
|
ou β,β–carotène-3,3'-diol, (3R,3'R) C40H56O2 Aspect : Cristaux prismatiques jaunes Masse molaire : 568,872 g.mol-1 Fusion : 215,5°C Ebullition : 227 °C (0,06 mm de Hg) Solubilité : Soluble dans le chloroforme, l'acétone, le
benzène, la pyridine,et l'éther. N° CAS : 144-68-3 |
|
On la
trouve dans le maïs d'où son nom. On en trouve aussi dans les poivrons, les
courges, les algues vertes et rouges. Sa
molécule est voisine de celle du β-carotène où deux groupes hydroxyles
remplacent deux hydrogènes. C'est
une molécule voisine et à action comparable à celle de la lutéine dans
l'organisme humain notamment au niveau de l'oeil. |
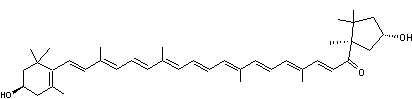
||
|
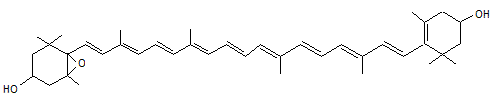
ou 5,6-dihydro-5,6-époxy-β,β-carotène-3,3'-diol C40H56O3 Aspect : Pigment
jaune vif Masse
molaire
: 584,871
g.mol-1 N°
CAS
: 640-03-09 |
|
Xanthine
possédant 2 fonctions alcool et une fonction époxyde ; on trouve cette
molécule dans de nombreuses plantes et dans des algues. |
||
|
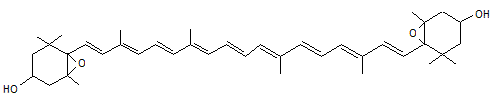
ou 5,6,5',6'-tétrahydro-diépoxy-β,β-carotène-3,3'-diol C40H56O4 Aspect : Pigment
jaune vif Masse
molaire
: 600,870
g.mol-1 N°
CAS
: 126-29-4 |
|
Xanthine
possédant 2 fonctions alcool et deux fonctions époxyde. C'est le
précurseur de la néoxanthine dans la voie de synthèse des caroténoïdes. On en
trouve dans les oranges, le potiron …. Utilisé
dans certains pays (mais pas dans l'UE) comme colorant alimentaire il est
désigné par le code E161e. |
||
|
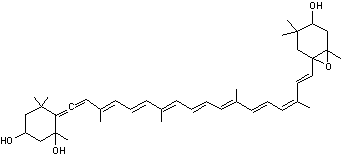
C40H56O4 Aspect : Pigment
jaune vif Masse
molaire
: 600,870
g.mol-1 N°
CAS 14660-91-4 |
|
Molécule
dérivant de la violaxanthine, jouant un rôle important dans la protection des
plantes contre le stress photo-oxydant. |
||
|
ou 3,3'-dihydroxy-β,β-carotène-4,4'-dione. C40H52O4 Etat
physique Solide Masse
molaire 596,839
g.mol-1 Fusion 216°C Solubilité Soluble
dans les huiles et les graisses. N°
CAS 472-61-7 |
|
Pigment
violacé à l'état solide qui colore en rose rouge les algues ou microalgues (Haematococcus
pluvialis ou Dunaliella salina par exemple) qui en contiennent ainsi que
les crabes, crevettes, écrevisses, saumons qui en consomment, ainsi que les
flamants roses par exemple. |
||
|
ou β,β-carotène-4,4'-dione. C40H52O2 Etat
physique Solide Masse
molaire 564,8397
g.mol-1 N°
CAS 514-78-3 |
|
Pigment
orange que l'on trouve dans certains champignons (Cantharellus cibarius,
la chanterelle d'où il a été extrait la première fois) mais aussi dans
certains oiseaux comme l'ibis rouge, et certains crustacés et poissons
(truites, saumons ….). Il est
utilisé comme additif alimentaire sous le code E161g. Cette
molécule ne diffère de celle de l'astaxanthine
que par deux fonctions alcool qui n'existent pas dans la canthaxantine. |
||
|
ou β,ψ-carotèn-3-ol,
(3R) C40H56O Masse
molaire 552,872
g.mol-1 Aspect Aiguilles
rouge sombre si recrista llisé dans un mélange
benzène-méthanol ; rouge orange si recristallisé dans un mélange
benzène-éther de pétrole. Fusion 160°C Solubilité
Soluble
dans le benzène et le chloroforme ; légèrement soluble dans l'éthanol et
l'éther de pétrole. N°
CAS 3763-55-1 |
|
Pigment
rouge-orange présent dans de nombreuses plantes, par exemple dans les
cynorrhodons. Utilisé
dans certains pays (mais pas dans l'UE) comme colorant alimentaire et désigné
par le code E161d. |
||
|
ou 3,3'-dihydroxy-k,k-carotène-6,6'-dione. C40H56O4 Masse
molaire 600,884
g.mol-1 Fusion 201°C N°
CAS 470-38-2 |
Remarque :Lorsqu'on ne dispose pas des lettres grecques on peut
les remplacer dans le nom du composé par des lettres latines, bêta devient b,
k représente kappa. C'est un cycle pentagonal. |
Pigment
présent dans le poivron rouge (capsicum annuum) et l'oléorésine du
paprika. |
||
|
Capsanthine |
L'association
capsanthine/capsorubine est utilisée sous la désignation E160c comme colorant
alimentaire (saucisses, fromages...) ; en fonction de sa concentration dans
les aliments, la couleur de ceux-ci peut varier du rouge sombre au jaune. |
Caroténoïde
principal de l'oléorésine (huile) extraite du paprika (capsicum annuum) Cette
molécule existe dans le paprika sous forme d'esters d'acides gras
(estérification des deux fonctions alcool en 3 et 3'). |
||
|
ou ψ,ψ-carotèn-16-ol C40H56O Masse
molaire 552,872
g.mol-1 Aspect Plaques
rouges si recristallisé dans un mélange benzène-méthanol. Fusion 168°C Solubilité
Soluble
dans le benzène et le sulfure de carbone ; légèrement soluble dans l'éthanol
; insoluble dans l'eau. N° CAS 19891-74-8 |
|
Pigment
présent dans de nombreuses plantes comme par exemple la tomate mais en très
petite quantité. |
||
|
|
|
Xanthine
existant en très faible quantité (état de traces) dans les plantes et les
algues. Dans
la laitue (Lactuca sativa) on la trouve en quantité non négligeable. |
1-3) Les
couleurs des caroténoïdes
Une
molécule possédant un groupement chromophore (voir annexe 1)
absorbe dans l'ultra-violet ; elle est incolore.
S’il y
a plusieurs chromophores et notamment des doubles liaisons conjuguées ![]() , l’absorption se
déplace vers les grandes longueurs d’onde c’est-à-dire de l’UV vers le visible
; la molécule peut devenir colorée (molécule chromogène)
; c'est le cas des caroténoïdes dont la couleur devient perceptible lorsqu'ils
possèdent au moins 7 doubles liaisons conjuguées ; le premier caroténoïde
coloré dans la série aliphatique donnée plus haut est donc le zéta carotène.
, l’absorption se
déplace vers les grandes longueurs d’onde c’est-à-dire de l’UV vers le visible
; la molécule peut devenir colorée (molécule chromogène)
; c'est le cas des caroténoïdes dont la couleur devient perceptible lorsqu'ils
possèdent au moins 7 doubles liaisons conjuguées ; le premier caroténoïde
coloré dans la série aliphatique donnée plus haut est donc le zéta carotène.
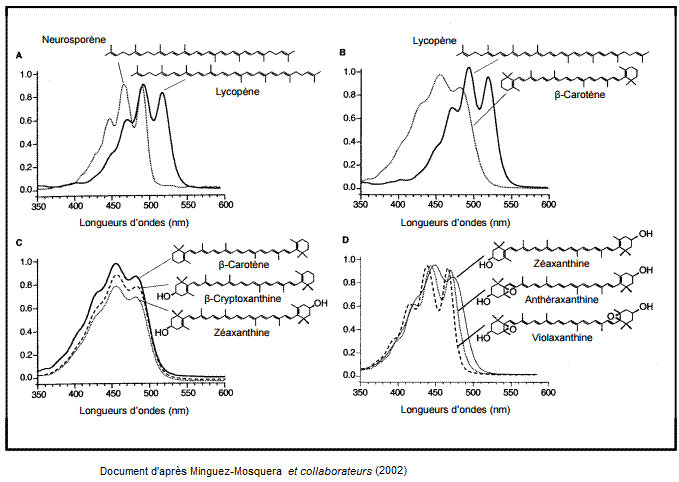
Le
document suivant permet d'apprécier les effets des changements structuraux des
caroténoïdes sur leur spectre d'absorption dans l'UV et le visible :
- A - Influence du nombre de doubles
liaisons dans la molécule.
- B - Influence de la présence de
cycles dans la molécule.
- C - Influence de la présence de
groupements hydroxyles dans la molécule.
- D - Influence de la présence de groupements époxydes dans
la molécule.
On
constate que :
- A - Lorsque le nombre de doubles
liaisons conjuguées augmente (neurosporène 9 , lycopène 11) on assiste à un
effet bathochrome.
- B - Lorsqu'apparaissent deux
cycles dans la molécule (un de chaque côté) (lycopène aucun cycle,
β-carotène deux cycles) on assiste à un effet hypsochrome.
- C - L'apparition d'un groupement
hydroxyle sur la molécule de β-carotène (β-Cryptoxanthine) puis de
deux groupements hydroxyle (Zéaxanthine) se traduit par un effet hypochrome.
- D - La présence d'un groupement
époxy (Anthéraxanthine) puis de deux (Violaxanthine) sur une molécule de
zéaxanthine conduit à un léger effet hypsochrome.
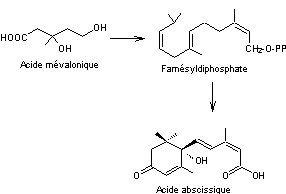
1-4) La
biosynthèse des caroténoïdes
Les voies
de biosynthèse des caroténoïdes dérivent de la biosynthèse générale des
isoprénoïdes. C'est à partir du phytoène qu'il peut y avoir des divergences
conduisant à une grande diversité de caroténoïdes.
C'est
la voie du mévalonate qui est la plus courante au départ de ces biosynthèses.
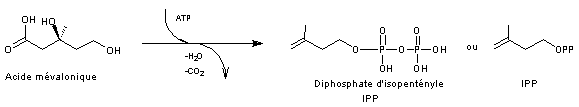
1-4-1) De l'acide mévalonique au phytoène :
- A partir de l'acide mévalonique on
passe à une unité isoprène par phosphorylation des 2 groupes alcool de l’acide
mévalonique (grâce à l’ATP) puis par élimination d’eau avec formation d’une
double liaison C=C, puis par décarboxylation (-CO2), l’ensemble
conduisant au 3-méthylbut-3-ènylpyrophosphate appelé aussi diphosphate
d'isopentényle et abrégé en IPP
- Il y a ensuite isomérisation de
l'IPP grâce à l'isopentényle diphosphate isomérase qui conduit au diphosphate
de diméthylallyle ou DMAPP :
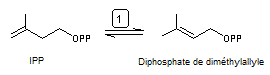
- puis une succession de réactions
conduisent d'abord au FPP (Diphosphate de farnésyle) puis au GGPP (Diphosphate
de digéranyle).
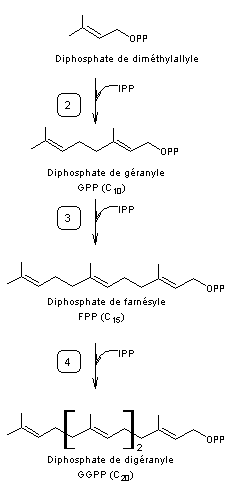
Dans la réaction -2- intervient
l'enzyme géranyldiphosphate synthétase.
Dans la réaction -3- intervient
l'enzyme farnésyldiphosphate synthétase
Dans la réaction -4- intervient
l'enzyme géranylgéranyldiphosphate synthétase
-
La condensation de deux unités GGPP conduit au phytoène qui est le premier
tétraterpène et le précurseur des caroténoïdes
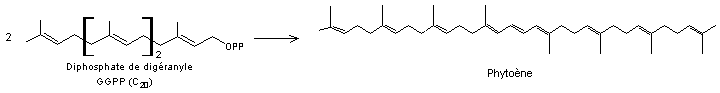
1-4-2) Du phytoène au lycopène
Une série
de désaturations enzymatiques (grâce à des enzymes désaturases) vont permettre,
à partir du phytoène (3 doubles liaisons conjuguées), d'augmenter ce nombre et
d'arriver au zéta carotène (apparition d'une couleur avec 7 doubles liaisons
conjuguées) puis au lycopène (11 doubles liaisons conjuguées).

1-4-3) Du lycopène aux carotènes alicycliques
Le
lycopène conduit par cyclisation des extrémités de sa chaîne, à des carotènes
alicycliques:
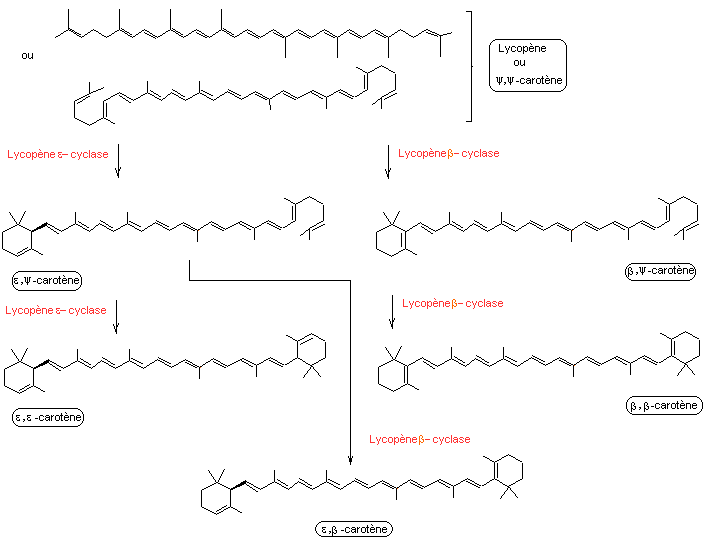
1-4-4) Des carotènes alicycliques aux xanthophylles
Enfin,
avec des enzymes d'oxydation spécifiques (enzymes hydroxylases) on passe des carotènes
alicycliques aux xantophylles correspondants :
- A partir du
β,β–carotène on obtient la zéaxanthine

- A partir du
β-ε-carotène on obtient la lutéine
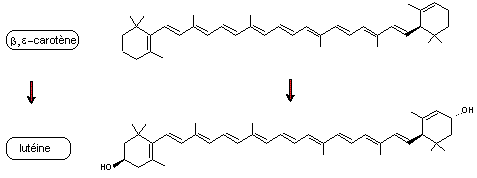
- A partir de
l'ε,ε-carotène on obtient la lactucaxanthine

1-5) Quelques
propriétés des caroténoïdes
1-5-1) Certains conduisent à la
vitamine A
Les
carotènes dont une partie de la molécule a la structure β sont source de
vitamine A, appelée rétinol ; on les qualifie de provitamine A.
Il
s'agit du β-carotène (β, β), de l'α-carotène (β,
ε), du γ-carotène (β, ψ) mais aussi d'une xanthophylle, la
β-cryptoxanthine.
Au
niveau des carbones 15 et 15' se produit une coupure oxydante
![]()
Il se
forme du rétinal
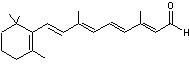
Une
réduction enzymatique change la fonction aldéhyde en fonction alcool primaire,
plus stable ; ce qui donne du rétinol
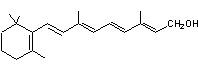
Le
β, β-carotène conduit à deux molécules de vitamine A, une seule pour
les autres.
Remarque :
L'appellation
"rétinol" (dans laquelle on perçoit le mot rétine) pour la
vitamine A est due à l'importance de ce composé dans la vision.
Le mécanisme
de la vision nécessite, au niveau de la rétine, du rétinal, qui se forme par
déshydrogénation du rétinol.
1-5-2) Ils interviennent dans la synthèse
chlorophyllienne
La
phase claire de la photosynthèse a lieu grâce aux pigments contenus dans les
membranes des thylakoïdes : chlorophylle A, chlorophylle B, xanthophylles
notamment.
La
chlorophylle A est le plus important de ces pigments. Les autres et notamment
les xanthophylles absorbent la lumière à de plus faibles longueurs d'onde
(photons d'énergie supérieure). Ils transmettent une partie de cette énergie
aux molécules de chlorophylle A. De cette façon ces pigments que l'on dit
accessoires renforcent l'action de celle-ci.
1-5-3) Ils ont des propriétés anti-oxydantes
Le
stress oxydant pour un organisme est un type d'agression des constituants des
cellules par des espèces réactives oxygénées (ERO) ou par des radicaux dont les
plus connus sont l'oxygène singulet 1O2, l'anion
superoxyde O2O-, le radical hydroxyle HOO ou le radical
peroxyle ROOO
-.
Les
caroténoïdes ont des propriétés anti-oxydantes dues essentiellement à leurs
nombreuses doubles liaisons. Leur action consiste, comme pour le lycopène par
exemple qui est l'un des plus puissants, à piéger l'oxygène singulet ou à
neutraliser certains radicaux comme les peroxyles notamment.
Les
apocaroténoïdes sont des composés terpénoïdes provenant du clivage oxydant des
caroténoïdes.
Ce sont
généralement les doubles liaisons qui sont oxydées par l'oxygène moléculaire à
l'aide d'enzymes CCD (Carotenoid Cleavage Dioxygenase), en formant des
aldéhydes ou des cétones de chaque côté de la rupture.
Cette
oxydation peut se faire sur l'une quelconque des doubles liaisons conjuguées du
caroténoïde, ce qui explique l'extraordinaire diversité de ces composés.
Ils
sont très largement distribués dans la nature et remplissent d'importantes
fonctions biologiques :
- Chez les animaux le clivage du
β-carotène conduit à la vitamine A et aux rétinoïdes.
- Chez les plantes ils donnent lieu
à des processus très variés :
x hormonal comme par
exemple l'acide abscissique ou ABA.
x attracteur d'insectes
pollinisateurs ; c'est le cas de la β-ionone.
x odeurs et saveurs,
couleurs des fruits et des fleurs ; c'est le cas du β-cyclocitral, du
géranylacétone, de la pseudo-ionone, de la bixine …..
- Chez les champignons, pour
certains d'entre eux, un individu reconnaît son partenaire sexuel grâce à des
phéromones comme par exemple les acides trisporiques.
Quelques
exemples d'apocaroténoïdes :
|
|
|
|
Vitamine
A Aspect : N°
CAS
: 68-26-8 Solubilité : Soluble
dans l'éthanol, l'acétone, l'éther, le benzène ; insoluble dans l'eau. |
Les
doubles liaisons sont toutes trans. Carence: L'apport quotidien recommandé (AQR) en vitamine A (soit A1 plus A2) se
situe entre 800 et 1000µg. |
La
vitamine A joue un rôle fondamental dans la vision. Elle intervient aussi
dans de nombreuses fonctions de l’organisme : développement de l'embryon,
croissance des cellules, renouvellement des tissus (peau, muqueuse
intestinale), système immunitaire. Elle
fut la première vitamine liposoluble découverte. Ce sont Mac Collum, Davis,
Osborne et Mendel qui la découvrirent en 1913. |
|
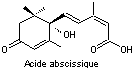
Acide abscissique Cristaux
blancs (lorsque recristallisé dans un mélange chloroforme, éther de pétrole). Masse
molaire
: Ebullition : Se
sublime à 120°C Densité : 1,193 Pouvoir
rotatoire spécifique
: Solubilité : Très soluble
dans l'acétone, l'éther, le chloroforme. 21293-29-8 |
C'est à partir de l'acide
mévalonique que l'acide abscissique est synthétisé dans les plantes. Les chloroplastes constituent
probablement le principal mais pas l'unique site de synthèse de l'ABA.
|
Phytohormone découverte dans les années
1960 et impliquée dans l'abscission des feuilles et la dormance des bourgeons
(on l'a même appelée la dormine). Elle agit sur la réaction au stress
hydrique des plantes en provoquant la fermeture des stomates (responsables
des échanges gazeux assurant la photosynthèse mais aussi des principales
pertes d'eau par évapotranspiration) ; elle agit également sur la régulation
de la germination des graines ; elle induit la synthèse des protéines de
réserves. C'est également la principale hormone inhibitrice, antagoniste des
gibbérellines. |
|
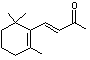
trans-β-Ionone C13H20O Masse
molaire
: 192,297
g.mol-1 Ebullition : 124°C
(10 mm de Hg) ; 73°C (0,1 mm de Hg). Densité : 0,945
(à 20°C) Indice
de réfraction
: 1,5198
(à 20°C) N°CAS : 79-77-6 Solubilité : Miscible
à l'éthanol et l'éther ; soluble dans le chloroforme ; légèrement soluble
dans l'eau. |
|
La
β-ionone a une odeur fruitée et boisée de cèdre et de framboise. EIle
existe dans le thé. Les
ionones proviennent de la dégradation des caroténoïdes dans les végétaux. Son
parfum sert à attirer des insectes pollinisateurs. |
|
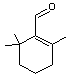
ou 2,6,6-triméthylcyclohex-1-ène-1-carboxaldéhyde C10H16O Aspect Liquide huileux Masse molaire : 152,23 g.mol-1 Densité : 0,943 (à 25°C) Indice de réfraction : 1,497 (à 20°C) Solubilité Soluble dans le chloroforme, le dichlorométhane,
l'acétate d'éthyle et le méthanol N°CAS 432-25-7 |
|
Odeur
de tabac. C'est
le terpénoïde volatil qui prédomine dans l'eau où des algues ont proliféré. |
|
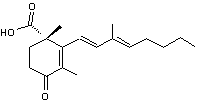
ou Trans-6,10-diméthylundéca-5,9-dièn-2-one C13H22O Aspect : Huile incolore Masse molaire : Ebullition : 124°C (sous 10 mm de Hg) Densité : 0,873 Indice de réfraction : 1,4670 N° CAS : 3796-70-1 Risques : |
|
Le
géranylacétone est présent dans de nombreuses substances (riz, tomates ….) ;
également dans l'huile essentielle extraite de l'écorce du Magnolia (Magnolia officinalis). C'est une fragrance de type floral. |
|
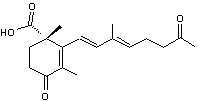
ou 6-10-diméthyl-3,5,9-undécatrièn-2-one. C13H20O Aspect Liquide huileux de couleur jaune à jaune sombre. Masse molaire Densité : 0,900 Indice de réfraction 1,530 Solubilité Soluble dans l'éthanol, insoluble dans l'eau. N° CAS 3548-78-5 ou 141-10-6 |
|
Cétone
dont la cyclisation en milieu acide conduit aux ionones. C'est
un agent de saveur. Odeur
de type floral et balsamique. |
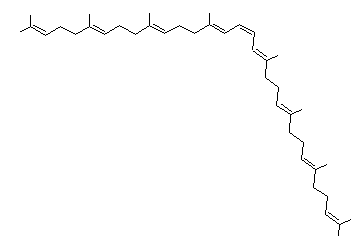
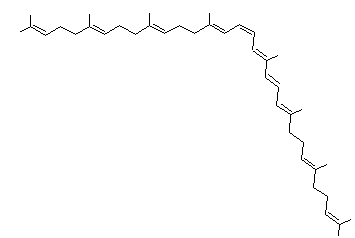
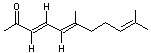
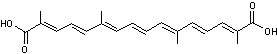
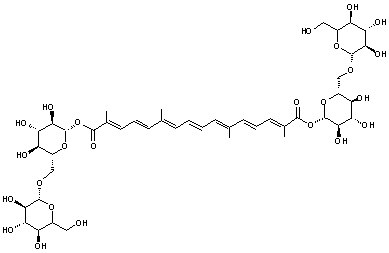
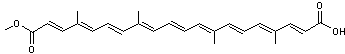
|
ou Acide 8,8'-Diapo-ψ,ψ-carotènedioïque. C20H24O4 Aspect Poudre rouge brique. Masse molaire Fusion: 286°C Solubilité Très soluble dans la soude ; soluble dans la
pyridine ; légèrement soluble dans l'eau et dans l'éthanol ; insoluble dans
l'éther et le benzène. N° CAS 27876-94-4 |
Crocétine
|
Caroténoïde
ayant une fonction acide carboxylique à chaque extrémité de sa molécule. Il
participe à la couleur du safran qui provient des stigmates de la fleur d'un
crocus (Crocus sativus). La crocine représentée ci-contre,
correspond à un diester de la crocétine avec un diholoside, le gentiobiose. Cette molécule présente aussi dans
le safran est la principale responsable de sa couleur rouge brique. La présence de ces diholosides aux
extrémités rend la molécule soluble dans l'eau ; on obtient une solution
orange. |
|
C25H30O4 Aspect : Prismes violets si la bixine est recristallisée
dans l'acétone. Masse molaire : 394,504 g.mol-1 Fusion : 198°C N° CAS : 6983-79-5 Solubilité : Soluble dans l'éthanol et l'acétone ; légèrement
soluble dans l'éther, le benzène et le méthanol. |
Bixine
Norbixine (all trans) C24H28O4 Masse molaire : 380,47672 g.mol-1 N° CAS : 542-40-5 |
Constitue
avec la norbixine, un colorant naturel, le rocou (ou annatto en anglais),
extrait des graines (arilles) de l'arbre d'annatto (Bixa orellana) et dont la couleur varie entre l'orangé et le
rouge. Il est
autorisé sous le nom de code E 160b comme colorant des margarines, des
minarines (margarines à faible teneur en matières grasses : 39 à 41%) et des
autres émulsions de matières grasses et des matières grasses non
émulsionnées. Il est
également utilisé comme colorant dans l'industrie cosmétique :
vernis à ongles, huiles capillaires, rouges à lèvres, produits de la maison
tels que la cire à parquets, l’encaustique, le cirage, la laque pour le
cuivre et la teinture à bois. La
bixine est liposoluble, la norbixine est hydrosoluble. |
|
-A- C18H26O3 Masse molaire : 290,40 g.mol-1 N° CAS 161023-29-6 -B- C18H24O4 Masse molaire : 304,39 g.mol-1 N° CAS 26057-02-3 -C- C18H26O4 Masse molaire : 306,40 g.mol-1 N° CAS 26055-09-4 |
-A-
-B-
|
Des
champignons faisant partie de l'ancienne division des zygomycètes,
synthétisent à partir du β-carotène des terpénoïdes en C18,
les acides trisporiques, qui sont des phéromones responsables de la différenciation
sexuelle dans ces organismes. |
Chromophore,
effet hypsochrome, effet bathochrome, effet hyperchrome, effet hypochrome
- Chromophore :
|
Se dit
d’un ensemble d’atomes à l’origine de la couleur d’une entité moléculaire et,
par extension et plus généralement, à l’origine d’une transition électronique
donnée. |
Quelques
exemples de chromophore : |
- Effet hypsochrome :
|
On
appelle effet hypsochrome tout effet qui provoque un déplacement du spectre
électronique d'absorption ou d'émission, d'une entité moléculaire, vers des
fréquences plus élevées (λ plus courtes). |
|
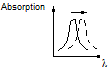
- Effet bathochrome :
|
On
appelle effet bathochrome tout effet qui provoque un déplacement du spectre
électronique d'absorption ou d'émission, d'une entité moléculaire, vers des
fréquences plus basses (λ plus longues). |
|
- Effet hyperchrome :
|
On
appelle effet hyperchrome tout effet qui provoque une augmentation de
l'absorption optique (ou de l'intensité de la coloration). |
|
- Effet hypochrome :
|
On
appelle effet hypochrome tout effet qui provoque une diminution de
l'absorption optique (ou de l'intensité de la coloration). |
|