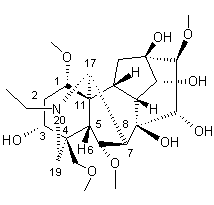
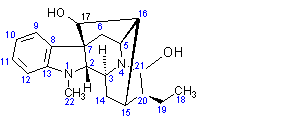
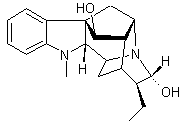
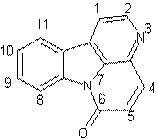
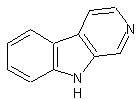
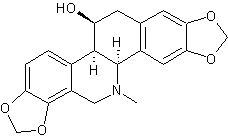
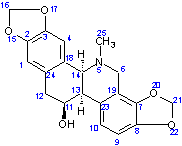
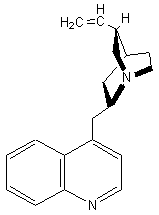
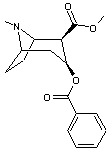
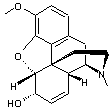
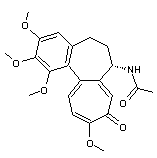
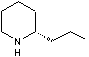
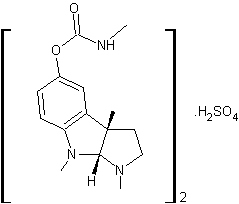
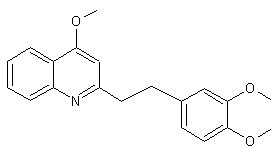
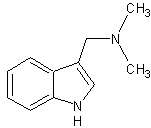
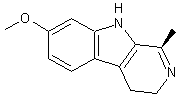
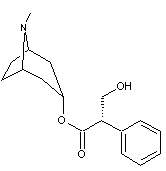
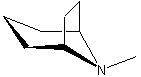
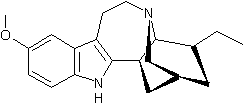
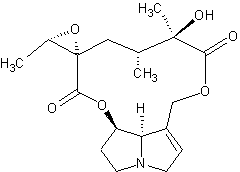
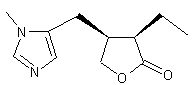
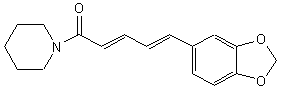
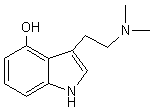
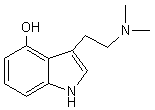
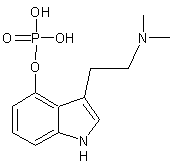
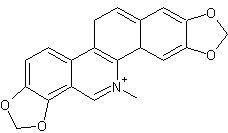
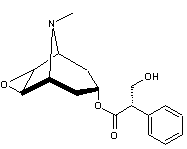
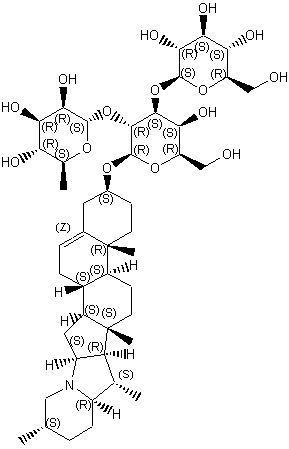
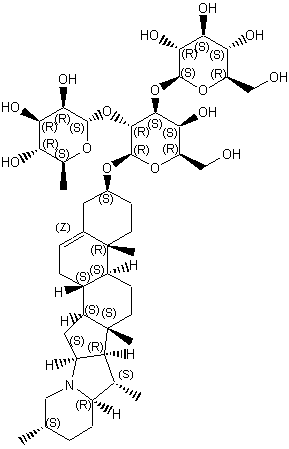
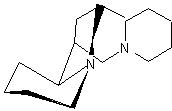
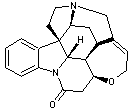
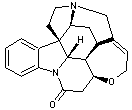
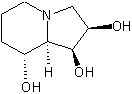
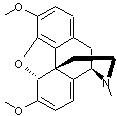
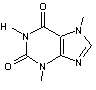
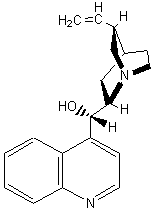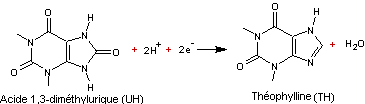LES ALCALOÏDES
Gérard GOMEZ
1) Définition :
On donne le nom général d'alcaloïde à des
substances :
v
azotées,
v
à caractère
basique,
v
presque toujours
hétérocycliques (azote dans le cycle),
v
à structure
souvent complexe,
v
le plus
souvent d’origine végétale mais aussi issues de microorganismes, d’organismes
marins et d’animaux,
v
dont l’activité
physiologique et pharmacologique est souvent marquée.
Parmi les effets physiologiques que l’on peut noter pour certains
d’entre eux, on trouve :
-
des effets sur
l’activité cérébrale et le système nerveux : stimulant, euphorisant,
excitant, hallucinogène, antalgique, hypnotique, paralysant, tétanisant,
dilatateur ou constricteur de la pupille, vomitif…
-
des effets sur
le système cardio-vasculaire : régulateur de la tension sanguine
(hypertension, hypotension), anti arythmique, bronchodilatateur….
-
Mais aussi, sans action directe sur le système nerveux :
lutte contre le paludisme, inhibiteur de division cellulaire….
Certains alcaloïdes (issus de plantes rares ou difficiles à
cultiver) ont été reproduits par synthèse. Quelques autres sont des dérivés de
produits naturels (héroïne dérivé de la morphine, LSD ….)
2) Un peu d’histoire :
Les recherches sur les alcaloïdes ont débuté très tôt avec
notamment les travaux de Friedrich
Sertürner qui fut un pionnier en ce domaine ; en 1805, à 22 ans, alors
qu’il n’était que commis pharmacien il montra que le constituant actif du jus
de pavot était un composé cristallisable basique qu’il appela morphine en l’honneur de Morphée, le
dieu des songes. Un autre pharmacien (Armand Seguin) avait affirmé, dans un
rapport à l'Académie des sciences, avoir isolé cette substance en 1804 mais ne publia
cette découverte qu'en 1814. Sertürner fait une autre publication importante en
1817 sur les effets de la morphine.
En 1809 Louis Nicolas Vauquelin découvre la
nicotine dans les feuilles de tabac.
Pelletier et
Magendie (François Magendie, 1783-1855, Professeur de médecine au Collège de
France ; Claude Bernard a été l’un de ses élèves) isolent l’émétine de
l’ipéca en 1817. Pelletier et Caventou découvrent la brucine en 1819 et la
cinchonine en 1820. La même année Robiquet isole la caféine des
graines de café. Mein découvre l’atropine dans la belladone en 1831 et
Pelletier la narcéine dans l’opium en 1832.
C’est Wilhelm Meissner (1792-1853), pharmacien à Halle qui décida
d’appeler alcaloïdes, à cause de
leurs propriétés de bases organiques à caractère alcalin, les principes
végétaux actifs dont les découvertes se multipliaient et Gay-Lussac qui proposa
d’accoler le suffixe -ine à leur nom.
En 1844 Wöhler
traite la narcotine, composé extrait
de l’opium et obtient une molécule exempte d’azote la méconine (une lactone dépourvue d’activité) et une molécule azotée
la cotarnine qui se révèle être un
composé actif. En 1860, l’allemand A.
Niemann extrait la cocaïne des feuilles de coca. Richard Willstätter
élève de Baeyer résout le problème de la
constitution des alcaloïdes du coca et effectue en 1901 la synthèse de la tropine, de la tropinone, et la
synthèse totale de la cocaïne. Paul Rabe (1869-1952) et Heinrich Wieland étudient les
alcaloïdes du quinquina ; Wieland et Clemens Schöpf analysent les alcaloïdes du lobelia. Hermann Leuchs et Sir Robert Robinson font des
recherches sur les alcaloïdes de la noix vomique ; parallèlement ils
établissent la structure de la morphine et Gates, réussit en 1952 sa synthèse
totale.
En 1958 deux canadiens Ralph Noble et Charles
Beer découvrent dans la
pervenche de Madagascar
un alcaloïde (vinblastine) qui agit sur la division cellulaire et
se montre une arme efficace dans la lutte contre les cancers, découverte suivie
très peu de temps après par la découverte de la vincristine de structure
voisine et qui se montre encore plus efficace.
3) Un classement des alcaloïdes :
Il est difficile d’établir d’une façon exhaustive, un classement
des alcaloïdes à partir de la structure de leur molécule ; on peut
cependant regrouper certains d’entre eux en considérant qu’on retrouve dans
leur formule certains noyaux relativement simples ; on distingue par
exemple :
·
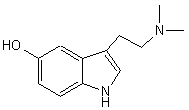
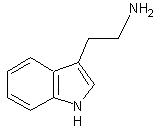
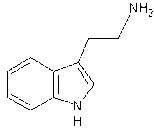
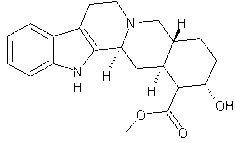
Les alcaloïdes renfermant le noyau indole :
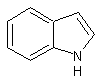
¾
Alcaloïdes simples : Gramine,
tryptamine, bufoténine,
psilocyne.
¾
Alcaloïdes issus de l’ergot de seigle : amides de l’acide
lysergique dont la lysergamide (ou ergine).
¾
Alcaloïdes issus de l’harmala (Peganum harmala) :
structure bicyclique renfermant à la fois un noyau indole et un noyau
pyridine ; harmine, harmaline, 9H-β-Carboline.
¾
Alcaloïdes issus du yohimbe (Pausinystalia yohimbe) :
réserpine, yohimbine.
¾
Alcaloïdes issus de la noix vomique (Strychnos nux-vomica) : brucine, strychnine.
·
Les alcaloïdes renfermant le noyau pyridine (ou pyridinique):
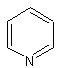
La nicotine, l’arécoline
(noyau pyridinique partiellement réduit).
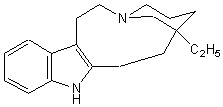
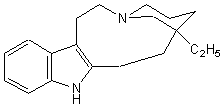
- Les alcaloïdes renfermant le
noyau pipéridine (noyau pyridinique réduit) :
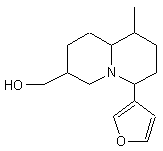
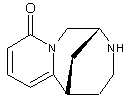
![]()
la
conicine , la pipérine.
·
Les alcaloïdes renfermant le noyau quinoléine :
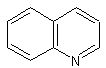
La cinchonine, la quinine, la galipine,
la lunacrine.
·
Les alcaloïdes renfermant le noyau isoquinoléine et isoquinoléine
réduit :
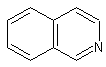
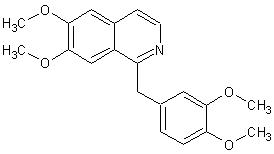
Les alcaloïdes de l’opium : narcotine,
papavérine, morphine, codéine, berbérine….
·
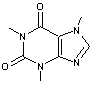
Les alcaloïdes renfermant le noyau purine :
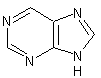
La caféine, la théobromine.
·
Les alcaloïdes renfermant le noyau pyrrolizidine :
![]()
La rétronécine,
la jacobine.
·
Les alcaloïdes renfermant le noyau indolizidine :
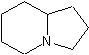
La castanospermine,
la swainsonine.
·
Les alcaloïdes renfermant le noyau tropane :
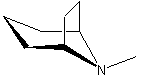
l’atropine la cocaïne la hyoscyamine, la tropine, la tropacocaïne.
4) Quelques alcaloïdes :
Le tableau ci-dessous donne
des renseignements sur quelques alcaloïdes rangés par ordre alphabétique :
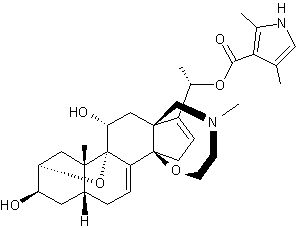
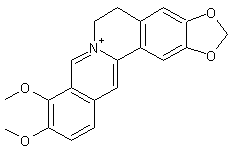
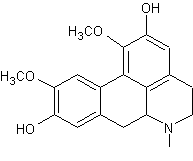
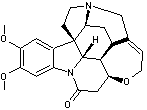
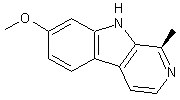
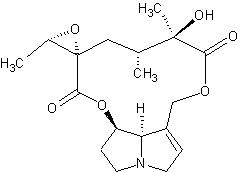
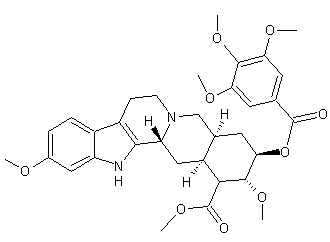
Aconine
– Aconitine – Ajmaline – Altéramide A - Arécoline – Aspidofractinine - Aspidospermine – Atropine – Batrachotoxine - Berbérine
– Boldine - Brucine - Bufoténine – Caféine
– Camptothécine – Canthin-6-one - Capsaïcine – Carboline – Castanospermine - Castoramine
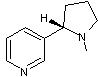
– Cathine – Chélidonine – Cinchonine – Cocaïne – Codéine – Colchicine - Coniine
– Cotarnine – Cusparine - Cytisine - Désoxynupharidine - Ellipticine - Emétine – Ephédrine - Ergine
– Ergocornine – Ergocristine –Ergocryptine –Ergométrine
–Ergosine - Ergotamine – Esérine
– Galipine - Gramine – Harmaline
– Harmine – Héroïne
– Hordénine – Hygrine - Hyoscyamine – Ibogaïne – Ibogamine - Jacobine
– Laudanosine – Leurosine - Lunarine
– Matrine – Mescaline – Michellamine
B – Morphine – Narcéine – Narcotine – Nicotine – Papavéraldine – Papavérine – (-) Papuamine – Pelletiérine - Pilocarpine – Pipérine – Psilocyne – Québrachamine – Quinine – Raubasine – Réserpine – Rétronécine
– Rhazinilame – Ricinine – Sanguinarine - Scopolamine –Serpentine – Solanine – Spartéine – Strychnine – Swainsonine
– Thébaïne – Théobromine – Théophylline – Tomatine – Tropacocaïne – Tropine
– Tryptamine – Tubocurarine
– Vasicine – Vératrine – Vinblastine – Vincamine – Vincristine – Vomicine – Yohimbine –
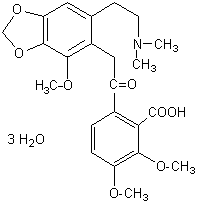
|
C25H41NO9 Masse
molaire : 499,596
g.mol-1 Fusion : 132°C Solubilité : Soluble
dans l’eau, l’éthanol, le chloroforme ; légèrement soluble dans l’éther
et la ligroïne. N°
CAS : 509-20-6 |
Cette
molécule contient le squelette aconitane :
Aconit
de Carmichael – Aconitum Carmichaelii Arendsii |
Principal alcaloïde extrait de Aconitum carmichaelii arendsii. Cette molécule ne diffère de l’aconitine
que par la présence de deux fonctions alcool à la place de deux fonctions
esters. |
|
C34H47NO11 Masse
molaire : 645,737
g.mol-1 Fusion : 204°C Solubilité : Très
soluble dans le benzène, l’éthanol, le chloroforme. N°CAS : 302-27-2
|
Cette
molécule contient le squelette aconitane :
|
Principal alcaloïde extrait de Aconitum napellus (nom local : casque de jupiter, famille des renonculacées) plante vivace rustique
portant au début de l’été de hautes grappes de fleurs en casque ; les
racines en tubercules constituent l’un des plus
puissants neurotoxiques du règne végétal. Molécule découverte en 1833 par
Geiger et Hesse.
Aconit casque de Jupiter - Aconitum napellus - Jardin
botanique national de Belgique |
|
ou (17R,21β)-ajmalane-17,21-diol C20H26N2O2 Aspect : Cristaux en écailles Masse molaire : 326,432 g.mol-1 Fusion : 206°C N° CAS : 4360-12-7 Solubilité : Soluble dans l’éthanol, le
chloroforme ; légèrement soluble dans l’éther, le benzène ;
insoluble dans l’eau. |
ou
Cette molécule contient le noyau ajmalane
|
Alcaloïde utilisé
contre les arythmies cardiaques. Elle est extraite de Rauwolfia serpentina
comme la réserpine. |
|
|
Un alcaloïde
tétracyclique cytotoxique isolé d’une culture de la bactérie marine Alteromonas sp. associée à une éponge Halichondria okadai. |
|
|
C8H13NO2 Masse molaire : Densité : 1,0485 à 20°C Indice de réfraction : 1,486 à – 20°C N° CAS : 63-75-2 |
|
Alcaloïde agoniste des récepteurs muscariniques de
l’acétylcholine. L’Arec, plante de la famille des palmiers dont une espèce
nommée l’areca catechu
par Linné fournit une amande semblable à la noix muscade qui contient
l’arécoline. Cette molécule est utilisée comme antihelminthique (contre
les vers parasites). |
|
|
Alcaloïde de la famille des kopsanes
(nouveaux alcaloïdes de type aspido) extrait des
écorces de tronc d’un Kopsia de Malaisie : Kopsia singapurensis. Beaucoup de membres de cette famille semblent être actifs
contre la résistance à la vincristine des cellules KB. |
|
|
ou 1-acétyl-17-méthoxyaspidospermidine C22H30N2O2 Aspect : Aiguilles (lorsque
recristallisé dans l’éthanol). Masse molaire : N° CAS : 466-49-9 |
|
Alcaloïde
extrait de l'écorce du quebracho blanc (Aspidosperma quebracho-blanco) arbre
de la famille des Apocynacées originaire de l'Amérique du sud. Ce composé
était autrefois utilisé (sous forme de sulfate) comme stimulant respiratoire,
antispasmodique et antipyrétique dans la fièvre typhoïde. |
|
C17 H23NO3 Aspect : Aiguilles
orthorhombique si recristallisé dans l'éthanol dilué. Masse molaire : |
La mandragore synthétise
naturellement en son sein deux alcaloïdes tropaniques
: la (S)-Hyoscyamine et la (S)-Scopolamine. Cependant, la (S)-Hyoscyamine se
racémise au cours de la vie de la plante et pendant les processus
d’extraction. Ainsi, une partie de la (S)-Hyoscyamine s’isomérise en
(R)-Hyoscyamine jusqu’à parfois atteindre un mélange racémique qu’on appelle
alors l’atropine. |
Alcaloïde extrait de la Belladone (Atropa
belladonna*); Il
apaise les spasmes et dilate la pupille en relâchant les muscles circulaires
de l’iris (mydriase passive) ; il est donc utilisé en ophtalmologie. Il accélère le cœur et diminue les
secrétions tant digestives que bronchiques, cutanées ou lacrymales. *Atropa vient
d'Atropos, nom de l'une des trois Parques, divinité de la mythologie grecque
qui présidait à la mort des humains (elle coupait le fil de la vie). * Belladonna
est un mot italien signifiant Belles dames par référence aux femmes italiennes
qui utilisaient la sève de la plante pour dilater leurs pupilles en pensant
que cela les rendaient plus belles. |
|
("le poison des grenouilles") C31H42N2O6 Masse molaire : 238,75 g.mol-1 Densité : 1,34 N° CAS : 23509-16-26 |
|
Alcaloïde cardiotoxique
et neurotoxique à structure stéroïdique, extraite de la peau de certains batraciens
et notamment de la grenouille colombienne Phyllobates aurotaenia ; cette toxine se lie aux
canaux sodiques et entraîne leur activation (ouverture) persistante. Cette molécule a été synthétisée en 1998. |
|
C20H19NO5 Aspect : Aiguilles
jaune-rouge lorsque recristallisé dans l'eau ; cristaux dans le chloroforme. Masse
molaire : 353,369
g.mol-1 Fusion : 145°C Solubilité : Très
soluble dans l’éthanol, l’éther. N° CAS : 2086-83-1 |
|
Alcaloïde isoquinoléinique à propriétés bactéricides et à activité
antibiotique à large spectre. La berbérine isolée de
Coptis chinensis (et
utilisée en médecine chinoise traditionnelle pour le traitement des
diarrhées) serait capable de réduire les concentrations plasmatiques de LDL-cholestérol. On en trouve également
dans l'Epine-vinette (Berberis vulgaris) de la famille des
berbéridacées un arbuste épineux très touffu à l'écorce grisâtre et au bois
très jaune d'environ 3m de haut, aux fleurs jaune pâle et à odeur
désagréable. Son fruit est constitué d'une baie rouge comestible. |
|
C19H21NO4 Masse
molaire : 327,375
g.mol-1 Fusion : 163°C Pouvoir
rotatoire : +127°
(à 21°C, raie D du sodium, en solution à 0,1 mol.L-1
dans l’éthanol). Solubilité : Très
soluble dans l’éthanol, l’éther. Sécurité : N°
CAS : 476-70-0 |
|
Dans
le boldo, la synergie alcaloïde (boldine)-flavones-essences(cinéol
et escaridol surtout) conduit à une action
hépato-stimulante qui en facilitant la digestion et la progression du bol
alimentaire combat les constipations résultant de la stase intestinale. Sa
découverte en 1826 est attribuée à Chevallier et Pelletan. |
|
ou 2,3-diméthoxy-strychnine C23H26N2O4 Masse molaire : 394,47 g.mol-1 175-178°C (décomposition) éthanol Risques : |
|
Alcaloïde de structure voisine de celle
de la strychnine. On en trouve dans l'enveloppe des graines de Strychnos nux-vomica,
un arbre à feuilles ovales dont les fruits jaunes sont de la taille d'une
balle de tennis, ou dans les fèves de St Ignace (graines de Strychnos Ignatii). |
|
Bufoténine ou Mappine ou N,N-diméthylsérotonine |
|
Alcaloïde
indolique hallucinogène isolé de la
peau de certains crapauds et des graines de Anadenanthera
peregrina,
un arbre d'Amérique du Sud, ainsi que dans la canne de Provence (Arundo donax) une graminée et dans
l'amanite tue-mouches (Amanita muscaria) un
champignon vénéneux de la famille des amanitacées. Découverte
en 1893 à partir du venin de crapaud, elle a été isolée pour la première fois
en 1934 par Wieland. Elle
fait partie de la famille des tryptamines qui sont des molécules psychotropes
et psychédéliques parmi les plus puissantes exacerbant les sensations et
conduisant à des hallucinations. C'est
également un dérivé méthylé de la sérotonine, neurotransmetteur présent dans
le cerveau des mammifères et lié au sommeil, à la perception de la douleur,
au comportement social, au comportement sexuel et à la dépression mentale. Comme
le LSD et la psilocine, la bufoténine
a une forte affinité aux récepteurs 5-HT2 de la sérotonine ce qui
en fait un agoniste de celle-ci. |
|
ou 1,3,7-triméthylxanthine ou 1,3,7-triméthylpurine-2,6-dione C8H10N4O2 Aspect : Aiguilles blanches Masse molaire: Ebullition : Se
sublime à 90°C Légèrement soluble dans l’eau. N° CAS : 58-08-2. |
1,3,7-triméthylxanthine
|
Alcaloïde de la famille des xanthines, excitant du système nerveux central et stimulant du système
cardio-vasculaire, présent dans le thé et le café. Le caféier commun ou coffea arabica est un arbre d’environ 5m de haut portant des
« cerises » à 2 noyaux (grains de café). Au sein de la plante, elle agit comme insecticide, tuant
ou paralysant les insectes qui s'en nourissent. |
|
C20H16N2O4 Aspect : Petits cristaux jaune
clair Masse molaire : 348,352 g.mol-1 Fusion : 260°C (se décompose) Densité : 1,513 N° CAS : 7689-03-4 Risques : |
|
Alcaloïde ayant montré
une activité contre les tumeurs et la leucémie mais dont la toxicité a
empêché l’utilisation directe à des fins thérapeutiques. Des dérivés de cette
molécule constituent des médicaments utilisés en chimiothérapie : l’irinotécan (cancer du colon) et
le topotécan (cancer de l’ovaire). La Camptothécine
a été isolée la première fois de Camptotheca acuminata, un arbre ornemental courant en Chine
centrale. |
|
|
Alcaloïde extrait d’Ailanthus altissima et
Zanthoxylum chiloperone ;
il s’est révélé efficace dans le traitement de la maladie de Chagas (présence dans l’organisme de trypanosoma cruzi). |
|
|
Capsaïcine |
Piment – Capsicum anuum – Jardin botanique national
de Belgique |
Alcaloïde à azote extracyclique,
naturel, présent en particulier dans le piment (genre capsicum) ; il a été découvert
et isolé en 1816. C’est le principe aromatisant majeur de l’oléorésine du
paprika. Il constitue (à raison de 20%) avec d'autres alcaloïdes voisins
la famille des capsaïcinoïdes. Ces composés activent les récepteurs vanilloïdes (nocirécepteurs) VR1 de la peau, de la
langue, de la vessie, par exemple, qui sont aussi activés par la chaleur
(45°C) et par l'acidité. Les capsaïcinoïdes
provoquent donc une douleur (sensation de piquant sur la langue, de brûlure
sur la peau) au début, mais par contact prolongé, ils désensibilisent ces
récepteurs entraînant un effet analgésique. |
|
ou 9H-Pyrido[3,4b]indole C11H8N2 Aspect : Cristaux jaune clair (aiguilles lorsque recristallisé dans
l’éthanol) Masse molaire: Ebullition : 391,3°C N° CAS : 244-63-3 Risques :
|
|
Alcaloïde largement répandu dans le règne animal et
végétal. Cette molécule agit comme inhibiteur de la monoamine oxydase. |
|
C8H15NO4 Masse molaire: N° CAS : 79831-76-8 Solubilité : Soluble dans l’eau Risques : |
|
Alcaloïde indolizinique
extrait des graines de Castanospermum australe. Activité antivirale. Castanospermum australe ou châtaignier
d'Australie est un arbre semper virens d'une dizaine de mètres de haut en
général (mais qui peut atteindre 40m dans son élément) à feuilles luisantes
et écorce rugueuse aromatique, à fleurs rouges orange et jaunes, dont les
fruits sont de longues gousses contenant au moins trois grandes graines
brunes d'où l'on extrait la castanospermine. |
|
C15H23NO2 Masse molaire: |
|
Alcaloïde produit par
un animal, le castor canadien ; utilisé comme insecticide. Il n’a pas de vertus
thérapeutiques. |
|
ou qataïne ou (1S,2R)-2-amino-1-phénylpropan-1-ol ou α-(1-aminoéthyl) benzèneméthanol,
[S-(R*,R*)] C9H13NO Aspect : Ecailles (lorsque recristallisé dans le méthanol). Masse molaire: Fusion: Très soluble dans l’éther, l’éthanol, le chloroforme). N° CAS : 492-39-7 |
|
Alcaloïde à azote extracyclique,
extrait de Catha edulis
(qat) que l’on trouve principalement au Yémen ou en Ethiopie. Les populations
de ces régions mâchent les feuilles de ces arbrisseaux et ressentent des
effets stimulants, euphorisants. |
|
ou Stylophorine C20H19NO5 Masse
molaire : 353,369
g.mol-1 Fusion : 135,5°C Ebullition : 220°C
(sous 0,002 mm de Hg) N°
CAS : 476-32-4 Solubilité : Soluble dans l’éthanol, l’éther, le chloroforme ;
insoluble dans l’eau. |
ou
chelidonum
majus
– Jardin botanique national de Belgique |
Alcaloïde ;
benzophénanthridine tertiaire présente dans la
chélidoine (chelidonum majus) de
la famille des papavéracées |
|
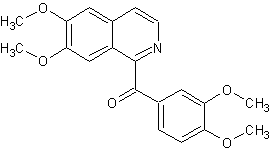
Cinchonine Aiguilles prismatiques quand recristalisé dans l'alcool ou l'éther. Masse molaire : 294,390 g.mol-1 N° CAS : 118-10-5 |
Cinchonine
Cinchonane
; C19H22N2 ; Masse molaire : 278,399
g.mol-1 |
Alcaloïde extrait de l'écorce de quinquina (un arbre
tropical) pour la première fois par Pelletier et Caventou (1820). |
|
Cocaïne Aspect : Poudre blanche floconneuse. Masse molaire : Ebullition : 187°C (à 0,1mm de Hg) Indice de réfraction : 1,5022 (98°C) Solubilité : Très soluble dans l’éthanol, l’éther, le benzène, la
pyridine ; soluble dans CS2 ; légèrement soluble dans
l’eau. N° CAS : |
|
Alcaloïde extrait des feuilles de coca ;
anesthésique local et stimulant du système nerveux central. Son usage
prolongé conduit à une grave toxicomanie. La coca est un arbuste épineux de 1,5 à 2m qui
appartient au genre Erythroxylum (famille des Erythroxylacées) ; E.coca
est traditionnellement cultivée dans la cordillère des Andes (Colombie –
Bolivie), son fruit est une gousse rouge allongée, la mastication de ses
feuilles permet de supporter la fatigue sans aliment. |
|
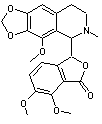
Codéine 299,37g.mol-1 |
|
Alcaloïde de l'opium, antalgique et sédatif. |
|
Colchicine Aspect : plaques jaunes
si recristallisé dans l'eau ; cristaux jaunes si recristallisé dans le
benzène. N° CAS : 64-86-8 |
colchique d'automne -Colchicum autumnale – Jardin
botanique national de Belgique Le colchique des
prés (faux safran, safran des prés), Colchicum
autumnale dont l'origine du nom serait Colchide ville dont le
roi était Aeétès le père de la belle et terrible
Médée la magicienne, éprise de Jason à qui elle apporta son aide pour s'emparer
de la Toison d'or puis qui devint la femme d'Egée, a des propriétés connues
depuis le Ier siècle (Dioscoride) qui ont été utilisées par la
médecine arabe classique pour soigner la goutte. Son utilisation en France
date de 1783 avec " l'eau médicinale" de Husson. Les principaux éléments présents dans le
colchique sont : la colchicine, une huile essentielle, des flavonoïdes de
l'amidon et des acides organiques. |
Découverte en 1820 par
Pelletier et Caventou et obtenue
cristallisée pour la première fois par A.Houdé en
1884, cet alcaloïde
à azote extracyclique, dérivé de la tropolone
et initialement extrait des graines séchées du colchique d'automne, a
été essentiellement utilisé en pharmacie pour lutter contre la goutte. Il
possède aussi un effet sur la division cellulaire (c'est un médecin sicilien,
Pernice, qui en 1880 met en évidence ses propriétés
antimitotiques qui devaient former la base du modèle pharmacologique de
plusieurs anticancéreux de notre pharmacopée actuelle [C.R. – André- Julien
Fabre - de la 26ème séance de la société d'histoire de la
pharmacie du 24 avril 2004]) et est de ce fait également utilisé
dans les études génétiques menées sur les plantes. On la prescrit aussi en cas de récidive de
péricardite si l'aspirine n'a pas eu d'effet. |
|
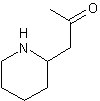
Conine ou Coniine ou Cicutine ou (S)-2-propylpipéridine |
|
Alcaloïde présent dans les fruits de la
grande ciguë (espèce Conium maculatum) qui est une plante bisannuelle à odeur
désagréable. Cette molécule a été découverte en 1831 par le
chimiste allemand Geiger. Albert Ladenburg la
synthétisa pour la première fois en 1886. |
|
ou 5,6,7,8-tétrahydro-4-méthoxy-6-méthyl-1,3-
dioxolo(4,5-g)isoquinoléin-5-ol C12H15NO4 Aspect : Aiguilles quand
recristallisé dans le benzène ; cristaux quand recristallisé dans
l’éther. Masse molaire : 237,252 g.mol-1 N° CAS : 82-54-2 |
|
Substance obtenue à partir de la narcotine extraite de l’opium.
C’est Wöhler qui l’obtint le premier en oxydant la narcotine. Il obtint en
même temps une lactone la méconine, en 1844. |
|
ou 2-[2-(1,3-benzodioxol-5-yl)éthyl]-4-méthoxyquinoléine C19H17NO3 Aspect : (α)
aiguilles blanches ou jaunes lorsque recristallisé dans l'éther de pétrole. (β)
aiguilles en prismes de couleur ambre. Masse molaire : 307,343 g.mol-1 Fusion : (α)
92°C (β)
111°C N° CAS : 529-92-0 Solubilité : Très soluble dans
l'éthanol, l'éther, le benzène, l'acétone ; insoluble dans l'eau. |
|
C'est un alcaloïde
qui peut être extrait de l'écorce de l'arbre Angostura, plante médicinale
présente en Amérique du sud et notamment au Venezuela. Les propriétés
médicinales de cette plante, aussi appelée Cusparia, Carony, Cusparia
febrifuga ou galipea cusparia ont été découvertes en 1824 par Johann Siegert. On l'utilisait contre les fièvres et les
désordres de l'estomac. La cusparine est utilisée
comme sympathomimétique (substance produisant les mêmes effets que le système
nerveux sympathique) et comme stimulant respiratoire. |
|
ou Sophorine ou Baptitoxine C11H14N2O Aspect : Cristaux prismatiques
blancs ou légèrement jaunes. Masse molaire : 190,241 g.mol-1 Ebullition : 218 (sous 2 mm de Hg) N° CAS : 485-35-8 |
|
Alcaloïde présent
notamment dans les fèves de
sophora (sophora secundiflora) petit arbre semper virens à fleurs
bleu- violet ayant des longues gousses. Les amérindiens
utilisaient ces fèves autrefois pour provoquer des hallucinations mais les
empoisonnements mortels étaient assez fréquents et ils ont abandonné cet
arbre au profit du peyotl. La cytisine est un
agoniste des récepteurs nicotiniques de l'acétylcholine et est utilisée pour
le traitement de l'addiction à la nicotine. Toxique à fortes doses. |
|
C15H23NO |
|
Alcaloïde de formule voisine de celle de la castoramine. On le trouve dans le rhizome du nénuphar jaune (radix nuphari lutei) ou dans le nénuphar japonais. A des effets tonifiants et augmente la pression sanguine. |
|
C7H14N2 Aspect : Aiguilles jaune
brillant. Masse molaire : 246,33 g.mol-1 Fusion : 316-318°C Ebullition : 495,4°C Densité : 1,257 Solubilité : Soluble dans le DMSO
et l’éthanol. |
|
Alcaloïde majeur des écorces de strychnos dinklagei
liane assez largement répandue en Afrique tropicale (Guinée, Côte d’ivoire…). Cette molécule a aussi été extraite des écorces d’un arbre de
l’Océan Indien ( Ochrosia elliptica ou Ochrosia borbonica). Possède des propriétés anti cancéreuses. |
|
ou 6’,7’,10,11-tétraméthoxyémétane C29H40N2O4 Aspect : Poudre amorphe Masse molaire : 480,639 g.mol-1 Soluble dans l’éthanol, l’éther,
l’acétone ; légèrement soluble dans le benzène
et le chloroforme ; insoluble dans l’eau. 483-18-1 |
|
Alcaloïde isolé en
1817 par Pelletier et Magendie des racines et du rhizome de différents ipécas
(Ipecacuanha), plantes de la famille des rubiacées. Molécule toxique, employée comme,
émétique (vomitif) et antiamibien. |
|
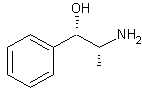
ou (R*,S*)-(±)-α-[1-Méthyl amino) éthyl]benzèneméthanol C10H15NO Aspect : Aiguilles lorsque
recristallisé dans l’éther. Masse molaire : 165,232 g.mol-1 Ebullition : 135°C (sous 12 mm de
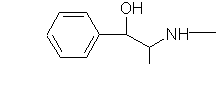
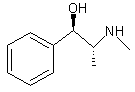
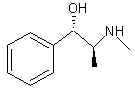
Hg) Densité : 1,1220 (à 20°C) Solubilité: N° CAS : 90-81-3 d-Ephédrine ou (S)-(R*,S*)-α-[1-Méthyl amino) éthyl]benzèneméthanol C10H15NO Aspect : Plaques lorsque
recristallisé dans l’eau. Masse molaire : 165,232 g.mol-1 Ebullition : 225°C Solubilité: N° CAS : 321-98-2 |
Ephédrine (±)
d-Ephédrine
l-Ephédrine ou (R)-(R*,S*)-α-[1-Méthyl amino) éthyl]benzèneméthanol C10H15NO Aspect : Plaques lorsque
recristallisé dans l’eau. Masse molaire : 165,232 g.mol-1 Ebullition : 225°C Densité : 1,0085 (à 22°C) Solubilité: N° CAS : 299-42-3 |
Ephédrine(±) : contenue dans la tige de l'Ephedra sinica. C'est un alcaloïde à azote extracyclique. Par réduction de la fonction alcool elle conduit à la métamphétamine. *Source : Histoire de la chimie p.
232 (G.Lockemann) Dunod
1962 |
|
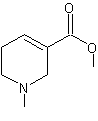
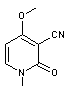
ou Lysergamide ou LSA C16H17N3O Masse molaire : 267,3257 g.mol-1 Solubilité: N° CAS : 478-94-4 |
|
Alcaloïde produit par l’ergot du seigle
(champignon parasite du seigle : Claviceps
purpurea Tul.). Dérivé de l'indole. Les alcaloïdes lévogyres
extraits du seigle et produits par l’ergot sont des amides de l'acide lysergique et provoquent des
contractions musculaires. Plus de 40 toxines ont été isolées des
sclérotes de Claviceps, ce sont
principalement des alcaloïdes ergopeptides dont les
plus toxiques sont : l'ergotamine, l'ergométrine, l'ergosine, l'ergocornine, l'ergocristine l'ergocryptine et l'ergotaminine
; ce sont des dérivés de l'acide lysergique ou isolysergique ; Il y a également des diastéréoisomères
des produits cités. |
|
ou Physostigmine
(sulfate) C30H44N6O8S Aspect : Cristaux
hygroscopiques (lorsque recristallisé dans le mélange acétone-éther). Masse molaire : 648,770 g.mol-1 Solubilité: N° CAS : 64-47-1 |
|
L’ésérine est extraite de la fève de Calabar
une graine d’une légumineuse (Physostigma
venenosum). Cet alcaloïde est un
inhibiteur de la cholinestérase. Il a des vertus parasympaticomimétiques. L’ésérine stimule la motricité
intestinale et urinaire, ralentit le cœur et provoque une hypersécrétion
bronchique. |
|
ou 2-[2-(3,4-diméthoxyphényl)éthyl]-4-méthoxyquinoléine C20H21NO3 Aspect : Cristaux en prismes
(lorsque recristallisé dans l'éthanol ou l'éther) ; cristaux en aiguilles
(lorsque recristallisé dans l'éther de pétrole). Masse molaire : 323,386 g.mol-1 Fusion : 115,5°C N° CAS : 525-68-8 Solubilité : Très soluble dans
l'acétone, le benzène, l'éther, l'éthanol. |
|
C'est un
alcaloïde qui peut être extrait de l'écorce de l'arbre Angostura (Galipea officinalis Hanckock), plante médicinale présente en Amérique du sud
et notamment au Venezuela. Les propriétés médicinales de cette plante, aussi
appelée Cusparia, Carony, Cusparia febrifuga ou galipea cusparia ont été
découvertes en 1824 par Johann Siegert. On
l'utilisait contre les fièvres et les désordres de l'estomac. Structure
voisine de la galipinine. |
|
ou ou N,N-diméthyl-1H-indole-3-méthanamine C11H14N2 Aspect : Aiguilles blanches
lorsque recristallisé dans le chloroforme. Masse molaire : 174,242 g.mol-1 Solubilité: N° CAS : 87-52-5 |
|
Alcaloïde toxique que l'on trouve dans
de nombreuses plantes (La canne de provence ou Arundo donax, la baldingère faux-roseau ou alpiste
faux-roseau Phalaris arundinacea...) qui a
été isolée pour la première fois des feuilles d'orge (Hordeum
vulgare) par Hans Von Euler et Erdtmann . Sa synthèse peut être menée à partir de
l’indole par la réaction de Mannich
c'est-à-dire la greffe d'un groupe dialcoylaminométhyle |
|
ou 4,9-dihydro-7-méthoxy-1-méthyl-3H-pyrido[3,4b]indole C13H14N2O Masse molaire : 214,262 g.mol-1 Solubilité: N° CAS : 304-21-2 |
|
Alcaloïde de Peganum harmala plante de la famille des
zygophyllacées. Molécule que l'on trouve dans différentes
autres plantes parmi lesquelles celles de type Banisteriopsis en même temps
que la 1,2,3,4-tétrahydroharmine
ou l'harmine. Ces molécules
ont la propriété lorsqu'elle sont absorbées
d'inhiber la monoamine oxydase (MAO) une enzyme naturellement présente dans
l'organisme humain. Le breuvage ayahuasca obtenu à partir de
l'écorce de lianes (Banisteriopsis)
et de plantes du type Psychotria , est à la base de pratiques
chamaniques des tribus indiennes d'Amazonie ; les Psychotria apportent à
l'organisme les molécules de N,N-diméthyltryptamine qui sont des agonistes des
récepteurs de la sérotonine ; en se fixant sur le récepteur 5-HT2A
(5-hydroxytryptamine 2A) elles provoquent des modifications de la perception
des images et des couleurs. Ces effets psychotropes ne sont en général pas
perçus lorsque l'on consomme les Psychotria seules
car les molécules de N,N-diméthyltryptamine
qu'elles apportent sont dégradées par la monoamine oxydase. Mais en présence
de plantes du type Banisteriopsis
qui inhibent l'enzyme, l'effet psychotrope a lieu et il s'ensuit un état de
transe pour l'individu qui a absorbé ce breuvage. Peganum harmala et les Banisteriopsis sont classées
comme stupéfiants par la législation. |
|
ou 7-méthoxy-1-méthyl-9H-pyrido[3,4-b]indole C13H12N2O Masse molaire : 212,246 g.mol-1 Ebullition : Se sublime N° CAS : 442-51-3 |
|
Principal alcaloïde de Peganum harmala plante
de la famille des zygophyllacées. Molécule que l'on trouve dans différentes
autres plantes parmi lesquelles celles de type Banisteriopsis en même temps
que la 1,2,3,4-tétrahydroharmine
ou l'harmaline. Ces molécules ont la
propriété lorsqu'elle sont absorbées d'inhiber la
monoamine oxydase (MAO) une enzyme naturellement présente dans l'organisme
humain. Le breuvage ayahuasca obtenu à partir de
l'écorce de lianes (Banisteriopsis)
et de plantes du type Psychotria , est à la base de pratiques
chamaniques des tribus indiennes d'Amazonie ; les Psychotria apportent à
l'organisme les molécules de N,N-diméthyltryptamine qui sont des agonistes des
récepteurs de la sérotonine ; en se fixant sur le récepteur 5-HT2A
(5-hydroxytryptamine 2A) elles provoquent des modifications de la perception
des images et des couleurs. Ces effets psychotropes ne sont en général pas
perçus lorsque l'on consomme les Psychotria seules
car les molécules de N,N-diméthyltryptamine
qu'elles apportent sont dégradées par la monoamine oxydase. Mais en présence
de plantes du type Banisteriopsis
qui inhibent l'enzyme, l'effet psychotrope a lieu et il s'ensuit un état de
transe pour l'individu qui a absorbé ce breuvage. Peganum harmala et les Banisteriopsis sont classées
comme stupéfiants par la législation. |
|
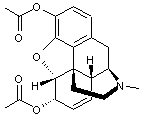
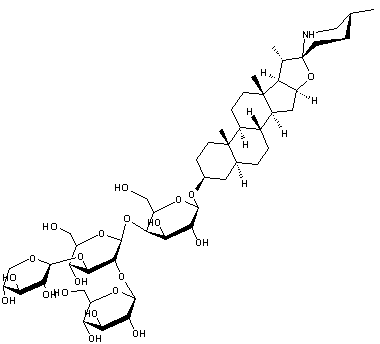
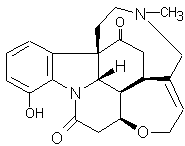
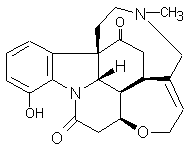
ou Diacétylmorphine C21H23NO5 Masse molaire : Densité : 1,56 (à 25°C) |
|
Opioïde dérivé d’un alcaloïde : la
morphine. C’est une drogue entraînant une dépendance physiologique et
psychologique.
|
|
Hordénine |
|
Nom : Dérivé savant du latin hordeum
"orge". |
|
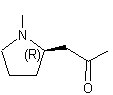
(R)-Hygrine ou (R) 1-(1-méthyl-2-pyrrolidinyle)-2-propanone C8H15NO Aspect : Huile épaisse,
jaunâtre, à odeur forte. Masse molaire : 141,211 g.mol-1 Fusion : 76,5°C (sous 11 mm de
Hg) Indice de réfraction : 1,4555 (à 20°C) N° CAS : 496-49-1 |
|
Alcaloïde à noyau pyrrolidine présent
dans les feuilles de coca et identifié en 1889 par Carl Liebermann. |
|
C17H23NO3 Aspect : Aiguilles (lorsque recristallisé dans l’éthanol
dilué) Masse molaire : Risques :
|
|
Molécule extraite de la belladone, la jusquiame, la datura ou la mandragore, plantes de la famille des
solanacées. C’est un alcaloïde à noyau tropane :
Le mélange racémique de ce stéréoisomère et de
son énantiomère constitue l'atropine. |
|
ou 12-méthoxyibogamine C20H26N2O Masse molaire : N°CAS : |
|
Substance à propriétés
hallucinogènes présente (avec d'autres alcaloïdes) dans un arbuste des forêts
équatoriales africaines l'iboga (Tabernanthe iboga) de
la famille des apocynacées. Cette
molécule a été utilisée dans le traitement de la dépression, puis pour
soigner certains toxicomanes (sevrage alcoolique….).
Elle est considérée comme un agent dopant et même comme un stupéfiant et sa
détention et sa consommation sont interdites en France depuis 2007. C'est un alcaloïde de type indole voisin de la psilocyne. |
|
C19H24N2 Masse molaire : 280,41 g.mol-1 Densité : 1,18 N° CAS : 481-87-8 |
|
Alcaloïde que l'on
trouve dans Tabernanthe iboga une plante qui pousse au Gabon.
L'ibogamine est un psychotrope, qui a montré des
propriétés anti-dépendance exceptionnelles chez les rongeurs. S'il en était
de même chez l'homme, cette molécule pourrait être utilisée contre les
dépendances à l'héroïne, voire même à la cocaïne ou à la morphine. Sa
synthèse totale a été menée à bien. |
|
Se présente sous forme d’écailles
lorsque recristallisé dans l’éthanol. C18H25NO6 228°C N° CAS : |
|
Alcaloïde
pyrrolizidinique présent dans le sénéçon jacobée (senecio jacobaea) et isolées dans les parties aériennes de
plantes japonaises. Cette molécule a une activité hépatotoxique. |
|
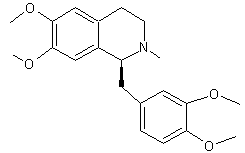
ou N-méthyl-1,2,3,4-tétrahydropapavérine ou 1-[(3,4-diméthoxyphényl)méthyl]-6,7-diméthoxy-2-méthyl-3,4-dihydro-1H-isoquinoléine. C21H27NO4 Masse
molaire : 357,4434
g;mol-1 Fusion : 89°C Ebullition : 468,1°C Densité : 1,111 N° CAS : 2688-77-9 |
|
Molécule existant dans l’opium
en petite quantité. C’est un alcaloïde benzylisoquinoléinique qui interagit avec les récepteurs
GABA, les récepteurs des opioïdes et les récepteurs de l’acétylcholine (comme
la nicotine) et produit des convulsions de type tétanique. |
|
C46H56N4O9 Aspect : Cristaux Masse
molaire : 808,959
g.mol-1 Fusion : 203°C N° CAS : 23360-92-1 Solubilité : Insoluble
dans l'eau |
|
Molécule voisine de la vinblastine ; elle présente chez les
animaux une activité antitumorale mais ne peut être utilisée avec succès dans
la thérapie humaine à cause de sa toxicité particulièrement élevée sur les
organes hématopoïétiques. |
|
C25H31N3O4 Masse
molaire : 437,531
g.mol-1 N° CAS : 24185-51-1 |
|
Alcaloïde extrait de lunaria biennis (la
monnaie du Pape) qui se dégrade en spermidine
molécule présente dans le sperme des mammifères. La lunarine
a des effets sur le système cardio-vasculaire, sur les muscles lisses, le
métabolisme des glucides et les sécrétions glandulaires. |
|
ou Matridin-15-one C15H24N2O Masse
molaire : 248,364
g;mol-1 Forme
α aiguilles ou plaques Forme
β prismes orthorhombiques Ebullition : 223°C
(sous 6 mm de Hg) Indice
de réfraction : 1,5286
(25°C) N° CAS : 519-02-8 Solubilité : Très
soluble dans l'éthanol, le benzène ; soluble dans l'eau, l'éther, l'acétone. |
|
Un des alcaloïdes contenus dans
les racines de plusieurs espèces de Sophora (japonica, subprostrata, alopecuroides)
identifié en 1958. Ses applications médicales principales : traitement de
certains cancers (col de l'utérus, leucémies), traitement des hépatites
virales, traitement de certaines affections cardiaques (myocardites virales
notamment) et traitement de certains problèmes de peau (psoriasis, eczéma).
La matrine est en outre un agoniste des récepteurs
opioïdes kappa. |
|
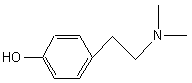
ou 3,4,5-triméthoxybenzènéthanamine C11H17NO3 Aspect : Cristaux
blancs Masse
molaire : 211,258
g;mol-1 Fusion : 35,5°C Ebullition : 180°C
(sous 12 mm de Hg) N° CAS : 54-04-6 Solubilité : Soluble
dans l’eau, l’éthanol, le benzène, le chloroforme ; insoluble dans
l’éther. |
|
Alcaloïde à azote extracyclique. Substance
hallucinogène produite en particulier par le peyotl (Echinocactus williamsii ), cactacée du Mexique et du sud-ouest
des Etats-Unis. Elle peut être obtenue
par synthèse. C’est le chimiste
allemand Ernst Späth qui en réalisa le premier la synthèse en 1919. |
|
|
A été isolée d’un
échantillon de Ancistrocladus korupensis ( Ancistrocladaceae), plante
originaire du Cameroun. Cette molécule a montré
une activité in vitro contre le VIH 1 et 2. C’est un alcaloïde
naphtylisoquinoléinique. |
|
|
Morphine 285,338 g.mol-1 255 °C Sublimation à 190 °C |
|
Ce nom vient de Morphée, Dieu des songes, fils de la nuit et du
sommeil. Pavot à opium : papaver
somniferum. Les graines sont ajoutées aux pains, gâteaux et mélanges pour
oiseaux. Le latex des capsules non mûres donne l’opium. Opium
officinal :
Titre 10% de morphine. Il doit ses propriétés à un grand nombre d’alcaloïdes |
|
C23H27NO8, 3H2O. |
|
Alcaloïde cristallin blanc à azote extracyclique
que l'on trouve dans l'opium. Il favorise le relâchement musculaire. Il a été
découvert par Pelletier
en 1832. |
|
a-Narcotine C22H23NO7 |
|
Alcaloïde de l'opium, extrait du latex du pavot à opium, tout comme la morphine, la codéine, la papavérine. Elle a été découverte en 1817 par Robiquet. Par oxydation la narcotine conduit à l’acide opianique. |
|
L-Nicotine ou (S)-3-(1-méthyl-2-pyrrolidinyl)pyridine C10H14N2 Aspect : Liquide huileux, hygroscopique, brunissant à la lumière. Masse molaire : Ebullition : 247°C 125°C (sous 18mm de Hg) Densité : 1,0097 (20°C) Indice de réfraction : 1,5282 (à 20°C) Solubilité : Très soluble dans l’éthanol, l’éther, le
chloroforme ; miscible à l’eau. N° CAS : |
|
Alcaloïde présent dans les feuilles de
tabac (2 à 8 % dans les feuilles séchées). Cette molécule a été découverte en 1809 par Louis-Nicolas Vauquelin. Elle a été isolée pour la première fois par
les chimistes allemands Posselt et Reimann. Sa structure a été élucidée par Pinner et Wolffenstein en 1895. Aimé Pictet (Professeur à Genève) joua un rôle
décisif dans sa synthèse en 1903. La L-nicotine se fixe sur les mêmes récepteurs
que l'acétylcholine et produit les mêmes effets, du moins en partie. Stimulant à faible dose, il provoque nausées
et vomissements à forte dose ; la dose létale se situerait entre 50 et
60 mg environ pour les humains. |
|
Se présente sous forme d’aiguilles
lorsque recristallisé dans l’éthanol. C20H19NO5 Masse molaire : 210,5°C Solubilité : Soluble dans le benzène et le chloroforme ; légèrement soluble dans
l’éthanol et dans l’éther ; insoluble dans l’eau. ; N° CAS : 522-57-6 |
|
Alcaloïde tiré de l’opium comme la papavérine dont elle
ne diffère que par une fonction cétone. |
|
C20H21NO4 Aspect : Aiguilles blanches quand elle est
recristallisée dans le chloroforme. Masse molaire : 339,386 g.mol-1 Fusion : 147,5°C Ebullition : Se sublime à 135°C Densité : 1,337 (à 20°C) Indice de réfraction : 1,625 (raie D du sodium) N° CAS : 58-74-2 Solubilité : Très soluble dans l’éthanol, le
chloroforme ; soluble dans l’acétone, le benzène, la pyridine ;
légèrement soluble dans l’eau. |
|
Alcaloïde de l'opium. Cette
molécule a été extraite de l'opium pour la première fois par Heinrich Emanuel Merck en 1848. |
|
(-) Papuamine C25H40N2 |
|
Un alcaloïde pentacyclique à
propriétés antifongiques extrait d'une éponge marine : Haliclona sp. |
|
C8H15NO Masse
molaire : 141,2108
g.mol-1 Densité : 0,918 Ebullition : 195°C N° CAS : 4396-01-4 |
|
Alcaloïde
aux propriétés vermifuges, contenu dans l'écorce des racines des grenadiers (punica protopunica)d'où il a été extrait par Tanret
(Charles-Joseph Tanret pharmacien et chimiste
français 1847-1917). Le nom de cette molécule a
été donné en hommage à Pelletier qui
avec Caventou a beaucoup travaillé sur les alcaloïdes. |
|
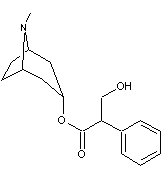
Pilocarpine |
Elle s’isomérise
facilement en isopilocarpine de faible activité biologique :
|
Alcaloïde extrait d'une plante
(Jaborandi) : Pilocarpus microphyllus de la famille des rutacées. Action sédative (ralentit le rythme cardiaque)
et sudorifique. |
|
Pipérine Cristaux prismatiques (lorsque recristallisé dans
l'éthanoate d'éthyle) ; cristaux en plaques ou prismes monocliniques (lorsque
recristallisé dans l'éthanol). Masse molaire : 285,338
g.mol-1 |
|
Alcaloïde responsable de la saveur piquante du poivre
noir (Poivrier
: Piper nigrum
de la famille des pipéracées) avec la chavicine et dans une bien moindre mesure l'isochavicine.
Cette molécule a été découverte par le chimiste Pelletier. |
|
ou Psilocine |
La psilocyne
La psilocybine C12H17N2O4P Masse molaire : 284,2481 g.mol-1 N° CAS : 520-52-5 |
Alcaloïde indolique hallucinogène extrait de
champignons (psilocybe, Stropharia..). Se
présente sous forme de poudre blanche. Cette molécule est moins stable que la psilocybine que
l’on trouve aussi dans les psilocybes
et qui correspond à l’hydrogénophosphate de psilocyne. La psilocybine se transforme en psilocyne après ingestion. Psilocyne et psilocybines sont des
agonistes sérotoninergiques 5-HT2 et 5-HT1. Cette propriété n'est pas
étonnante lorsque l'on compare la formule de la molécule de psilocyne à celle de la sérotonine :
|
|
C19H26N2 N° CAS : 4850-21-9 |
|
Alcaloïde indolique
extrait de l'écorce de certains arbres d' Amérique
du sud (Aspidosperma). |
|
ou 6’-méthoxycinchonan-9-ol,
(8α,9R) C20H24N2O2 324,417 g.mol-1 177 °C (anhydre) 57 °C (hydraté) Indice de réfraction : Très soluble dans l’éthanol, la pyridine ;
soluble dans l’éther, le chloroforme ; légèrement soluble dans l’eau et
l’acétone. N° CAS :
130-95-0 |
Une solution de quinine est normalement transparente et
incolore. Quand on l'éclaire avec un laser UV, on voit la lumière bleue émise
par fluorescence de la molécule de quinine (λ fluorescence =
450 nm) sur le trajet du faisceau UV.
|
Molécule (alcaloïde) extraite de la poudre d'écorce
(dans laquelle elle est présente à raison de 2 à 15%) du quinquina rouge (Cinchona ledgeriana
; c'est Linné qui donnera le nom Cinchona en souvenir de la Comtesse El Cinchon
épouse du vice-roi du Pérou, guérie grâce à cette drogue) plante de la
famille des rubiacées, vivant dans la cordillère des Andes à des altitudes
d'environ 2000m et actuellement cultivée en Asie. C'est un agent antimalarique (antipaludéen). C'est également une base
utilisée pour la résolution des inverses optiques à partir
du racémique
d'un acide. Elle est utilisée comme agent
d’amertume dans certaines boissons (« tonics »). |
|
C21H24N2O3 |
|
Cette molécule obtenue par
hydrogénation de la serpentine, autre alcaloïde extrait des
racines de pervenches (vinca) à l'aide de butanol,
possède des propriétés vasodilatatrices: elle augmente
la taille des vaisseaux sanguins en cas d'insuffisance respiratoire
cérébrale, d'artérite des membres inférieurs ou trouble de vasodilatation
périphérique. |
|
Rivasine-Serparsine 608,679 g.mol-1 264,5°C Ethanol, benzène,
éthanoate d’éthyle ; légèrement soluble dans l’eau, l’éther et
l’acétone. N° CAS : 50-55-5 |
|
Alcaloïde. Molécule utilisée dans le
traitement de l'hypertension artérielle et comme tranquillisant
(perturbations émotionnelles). Elle abaisse l'activité du système nerveux
orthosympathique, cette inhibition expliquant l'abaissement de la pression
artérielle et du rythme cardiaque ; elle abaisse le taux de sérotonine et de dopamine dans le système nerveux central
ce qui explique son effet tranquillisant. La racine de Rauwolfia serpentina
en contient. Rauwolfia serpentina ou
serpentaire de l'Inde appartient à la famille des apocynacées, c'est un arbuste
à feuilles caduques de 1m de haut qui ressemble à un laurier rose ; Rauwolfia en
souvenir de Léonhard Rauwolf
médecin botaniste du XVI ème siècle qui
voyagea aux Indes et serpentina en raison de ses
grosses racines pivotantes qui ressemblent à des serpents. La mangouste,
petit mammifère à pattes courtes consomme ses feuilles avant d'affronter le
cobra, pour se protéger du venin de celui-ci. La réserpine est le premier alcaloïde naturel
qui a été utilisé pour traiter une maladie psychiatrique. |
|
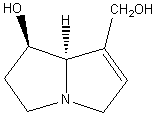
(+)-Rétronécine C8H13NO2 Cristaux (lorsque recristallisé dans
l’acétone) Masse molaire: N° CAS : 480-85-3 |
|
Principal représentant des bases
de nécine, alcaloïdes de type pyrrolizidine très répandus dans la nature et ayant de
multiples activités biologiques ; on leur attribue des propriétés mutagènes
et sont reconnus comme agents hépatotoxiques. |
|
|
Alcaloïde indolique extrait de
différentes espèces d’Apocynacées et appartenant au groupe aspidospermane. Isolé la première fois en 1965 par H.A.Linde de la plante Melodinus australis il a été trouvé aussi dans Rhazya stricta Decaisne, Aspidosperma quebrachoblanco
et Kopsia singapurensis. Possède une puissante action antitumorale. |
|
|
Ricinine |
|
Alcaloïde
cristallisé blanc, au goût amer, extrait de graines de ricin (Ricinus communis)
appelé aussi ricidine. Son ingestion peut causer
des vomissements et d'autres réactions toxiques (dommages au foie et aux
reins, convulsions, hypotension et mort). Remarque : ne pas confondre avec la ricine
une glycoprotéine
du ricin, formée de deux chaînes polypeptidiques reliées par un pont disulfure,
l'une de ces chaînes ayant des effets toxiques ; elle inhibe la synthèse des
protéines en agissant sur l'ARN des
ribosomes. La
ricine est proche de la curcine ou curcasine. |
|
C20H15NO5 Aspect : Cristaux si recristallisé dans l'éther ou l'éthanol. N°
CAS
: 2447-54-3 |
|
Alcaloïde
présent dans différentes plantes dont la sanguinaire du Canada (Sanguinaria canadensis) et
dans la chélidoine (chelidonum majus) toutes deux de la famille des papavéracées. Cette molécule a été découverte par le chimiste
américain Dana en 1829. C'est
un composé toxique produisant à dose élevée, vomissements, brûlures au niveau
des muqueuses, troubles cardiaques et visuels… |
|
(-)-Scopolamine ou Hyoscine C17H21NO4 Masse molaire : 303,3529 g.mol-1 Fusion : 59°C N° CAS 51-34-3 |
|
Alcaloïde extrait des racines de Scopolia atropides et de nombreuses plantes de
la famille des solanacées : jusquiame noire, graines de datura et
belladone. Molécule voisine de celle de l’atropine mais alors que celle-ci est un excitant central, le scopolamine a une action sédative, tranquillisante,
légèrement euphorisante, favorise le sommeil, a un effet amnésiant. Elle
renforce l’action des hypnotiques et tranquillisants. Par voie percutanée elle est essentiellement utilisée
comme antinauséeux dans la prévention du mal des transports. On l’utilise aussi pour lutter contre la maladie de
Parkinson. |
|
Serpentine |
|
Molécule extraite des racines de pervenches (vinca) à l'aide de butanol. Par hydrogénation on obtient
la raubasine (C21H24N2O3,H2O). Ne pas confondre avec la serpentine minérale
Mg3Si2O5(OH)4. |
|
C45H73NO15 Aspect : Aiguilles lorsque recristallisé
dans l’éthanol aqueux. |
Atropa bella-donna – Jardin botanique national de Belgique. |
Un des glycoalcaloïdes de la belladone (Atropa belladonna). On en retrouve dans la pomme de terre
(tige, feuilles et même tubercule mais en petite quantité). Composé toxique au delà d'une certaine dose. Molécule découverte
par Desfosses en 1820. |
|
Spartéine Fusion : 30,5°C Ebullition : 325°C ; 173°C à 8 mm de Hg. Densité : 1,0196 (à 20°C) Indice de réfraction : 1,5312 (raie D du sodium à 20°C) N° CAS : 90-39-1 Solubilité : Très soluble dans éther, éthanol, chloroforme. |
ou
|
Alcaloïde extrait du spart à balai ou
genêt à balai (Genista scoparia ou cystisus scoparius) arbrisseau à branches nombreuses,
flexibles, idéales pour faire des balais. On trouve aussi cet alcaloïde dans
une variété de lupin (Lupinus mutabilis). |
|
(-)Strychnine |
Poison violent et tétanisant comme la brucine. C'est une base utilisée pour la résolution des inverses optiques à
partir du racémique d'un acide. |
|
|
C8H15NO3 Masse molaire : Fusion : 143-144°C Solubilité : Dans l’eau : 10g.L-1 N° CAS : 72741-87-8 |
|
Alcaloïde indolizidinique
existant dans les angiospermes et certains champignons. A été isolé la
première fois en Australie dans Swainsona canescens. C’est un puissant inhibiteur de l’α- mannosidase. A une activité anti cancéreuse. |
|
Thébaine Aspect : Lamelles quand recristallisé dans l’éther. Masse molaire : 311,375 g.mol-1 Fusion : 193°C Ebullition : Se sublime à 91°C Densité : 1,305 (à 20°C) N° CAS : 115-37-7 Solubilité : Très soluble dans l’éthanol et le
chloroforme ; soluble dans le benzène ; légèrement soluble dans
l’éther ; insoluble dans l’eau. |
|
Molécule voisine de la morphine et de la codéine,
mais à action euphorisante au lieu de calmante. N'a pas d'utilisation
thérapeutique. Elle a été découverte par Pelletier en 1835. |
|
Théobromine C7H8N4O2 Aspect : Aiguilles quand recristallisé dans l’eau. Masse molaire : 180,165 g.mol-1 Fusion : 357°C Ebullition : Se sublime à 290°C N° CAS : 83-67-0 Solubilité : Légèrement soluble dans l’eau et
l’éthanol. |
|
Alcaloïde présent dans le cacao et donc dans le
chocolat. La molécule est très voisine de celle de la caféine. On utilise la
théobromine dans les cas d'insuffisance respiratoire chronique. Le cacaoyer (Theobroma
cacao) est un arbre de 5m de haut environ ,
portant des cabosses (dont l’intérieur ressemble à des épis de maïs) qui
regroupent 25 à 60 graines aplaties (appelées fèves de cacao). |
|
1,3-diméthylxanthine ou 3,7-dihydro-1,3-diméthyl-1H-purine-2,6-dione. C7H8N4O2 Aspect : Aiguilles ou lamelles quand recristallisé dans
l’eau.. Masse molaire : 180,165 g.mol-1 Fusion : 273°C N° CAS : 58-55-9 Solubilité : Soluble dans l’eau ;
légèrement soluble dans l’éther et le chloroforme. |
Obtention de la
théophylline
|
Dérivé de la xanthine. |
|
Tomatine Densité : 1,48 N° CAS : 17406-45-0 |
|
Glycoalcaloïde qui existe dans les
extraits de racines des plants de tomate sauvage. |
|
C15H19NO2 Aspect : Lamelles Masse molaire : 245,318 g.mol-1 Fusion : 49°C Ebullition : Se décompose Densité : 1,0426 (à 100°C) Indice de réfraction : 1,5080 (raie D du sodium 100°C) N° CAS : 537-26-8 Solubilité : Très soluble dans le benzène, l’éther,
l’éthanol. |
|
Alcaloïde extrait des feuilles de coca
de Java et utilisé comme anesthésique. C’est un puissant anesthésique utilisé
à la place de la cocaïne. Il est plus stable que la cocaïne en solution. On l’obtient également par synthèse. |
|
ou 8-méthyl-8-azabicyclo[3,2,1] octan-3-ol, endo C8H15NO Aspect : Lamelles hygroscopiques Masse molaire : 141,211 g.mol-1 Fusion : 64°C Ebullition : 233°C Densité : 1,016 (à 100°C) Indice de réfraction : 1,4811 (raie D du sodium 100°C) N° CAS : 120-29-6 Solubilité : Très soluble dans l’eau, l’éther, l’éthanol. Risques :
|
|
Alcaloïde que l’on peut obtenir par
hydrolyse basique de la tropacocaïne ou de l’atropine. |
|
Aspect : Aiguilles quand recristallisé dans le mélange
éthanol-benzène. Masse molaire : 160,215 g.mol-1 Fusion : 118°C Ebullition : 137°C (sous 0,15 mm de Hg) N° CAS : 61-54-1 Solubilité : Soluble dans l’éthanol et
l’acétone ; insoluble dans l’eau, l’éther, le benzène, le chloroforme. |
|
Alcaloïde dérivé de l'indole présent dans les acacias. |
|
C37H41N2O6 Masse molaire : 609,7312 g.mol-1 N° CAS : 6989-98-6 |
|
Curare non dépolarisant ; c’est un
antagoniste spécifique des récepteurs nicotiniques. On peut l’extraire de chondodendron tomentosum une
liane de la famille des Menispermacées. Il n’est plus utilisé en anesthésie générale
au profit de curares synthétiques. Encore utilisé aux USA pour des exécutions capitales par
injection. |
|
C11H12N2O |
Adhatoda vasica |
Les feuilles de la plante adhatoda
vasica contiennent deux alcaloïdes : la
vasicine et la vasicinone (produit d'oxydation de
la vasicine). |
|
Vératrine C32H49NO9 |
|
Alcaloïde trouvé par Pelletier et Caventou dans les graines de la cévadille (veratrum sabadilla),
et dans l'ellébore (ou hellébore) blanc (veratrum
album) une plante vivace de la famille des renonculacées dont les fleurs
s'épanouissent en hiver. Meissner a aussi contribué à leur
découverte. |
|
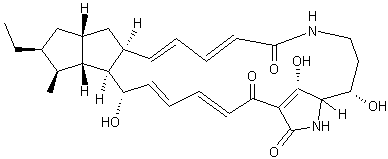
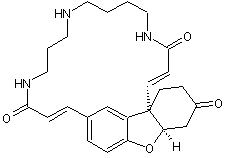
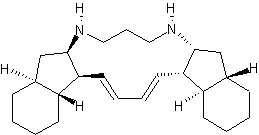
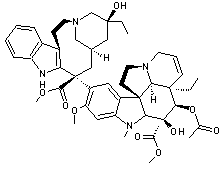
Vinblastine |
|
Cette molécule découverte en 1958
par deux américains, R.Noble
et C. Beer peut être extraite de la pervenche de Madagascar (Catharanthus roseus). Elle est active dans le traitement de la
maladie de Hodgkin. L'un des dérivés de cette molécule,
le 5'-nor anhydrovinblastine ou 3',4'-didéhydro-4'-dioxy-c' novincaleucoblastine est un
anticancéreux (cancer du poumon « non à petites cellules » et
cancer du sein) commercialisé sous le nom Navelbine
® ; il a été mis au point en 1978 par le Professeur Pierre Potier et son
équipe de Gif-sur-Yvette. |
|
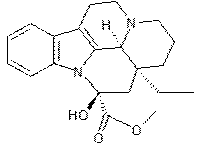
C21H26N2O2 |
|
Vasodilatateur qui améliore la
circulation sanguine cérébrale. C’est un alcaloïde indolique que l’on trouve
dans les feuilles de vinca minor.(30 à 50%). |
|
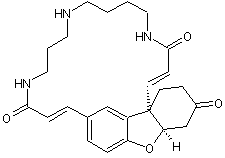
C46H56N4O10 |
|
C’est un vinca-alcaloïde,
médicament commercialisé sous le nom Oncovin ®
utilisé en chimiothérapie ; il entraîne un arrêt en métaphase de la
division cellulaire, par fixation sur la tubuline intracellulaire du fuseau. On peut l’extraire de la pervenche
de Madagascar (Catharanthus roseus). Cette
molécule se montre active notamment dans les leucémies aiguës de l’enfant. |
|
Vomicine |
|
Alcaloïde aux effets voisins de ceux de la brucine
; on la trouve dans nux vomica
(l'arbre à strychnine). |
|
C21H26N2O3 Aspect : Aiguilles lorsque recristallisé
dans l’éthanol dilué. Masse molaire : 354,4427 g.mol-1 Ebullition : Se sublime à 160°C Solubilité: N° CAS : 146-48-5 |
|
Principal alcaloïde du yohimbe
(Pausinystalia yohimbe de
la famille des rubiacées). Cette molécule est utilisée en traitement d’appoint de
l’hypotension orthostatique. On lui prête des propriétés aphrodisiaques. |