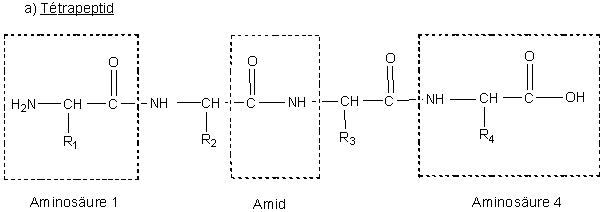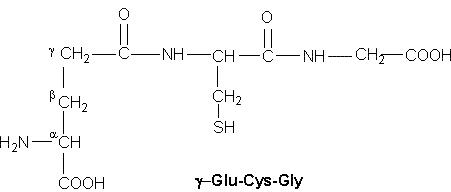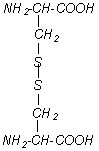AMINOSÄUREN
(Wolfgang WERNER,
Münster)
Die Bezeichnung Aminosäure verwendet man in der Regel mit der
Einschränkung auf proteinogene Aminosäuren. Daher ist ein kurzer Blick auf Proteine
für das Verständnis des inneren Zusammenhangs nützlich. Diese Aminosäuren haben
eine gleiche Grundstruktur (s. Abb. 1) und werden als natürliche Aminosäuren
bezeichnet.
Proteine, Albumine, Globuline
Für die Substanzen, die den Aufbau menschlicher und tierischer Gewebe
ausmachen, prägte Jöns Jakob Berzelius
(1779-1848) den Begriff Proteine von griech. proteos der Erste, der Wichtigste.
In einem 1840 erschienenem Lehrbuch der Chemie von Melchers wird der Begriff
das erste Mal verwendet. Die deutsche Bezeichnung Eiweiß ist aus der täglichen
Erfahrung verständlich, wenn dabei auch nicht das gekochte Ei, sondern das
Eiklar gemeint ist. Bei der weißen Masse im gekochten Ei oder dem Spiegelei
handelt es sich um denaturiertes Eiweiß, dessen ursprüngliche oder natürliche
Struktur in diesem Fall durch Hitze zerstört wurde. Die Bezeichnung Albumin
(lat. albus weiß) für eine Proteingruppe leitet sich davon ab. Durch Bildung
von zusammengesetzten Worten wie z.B. Ovalbumin (lat. ovus Ei) oder
Serumalbumin (lat. serum Blutwasser) versucht man Albumine nach ihrer Herkunft
zu differenzieren, da dies mittels Schmelzpunkt oder Siedepunkt nicht möglich
ist. Es handelt sich meist nicht um einheitliche Spezies. Die Elementaranalyse
ergibt jeweils ähnliche Werte und eignet sich ebenfalls nicht zur
Unterscheidung. Das Gleiche gilt auch für die Gruppe der Globuline (lat.
globulus Kügelchen), für deren Namen die roten Blutkörperchen, die unter dem
Mikroskop in der Aufsicht wie Kügelchen aussehen, Pate gestanden haben. Auch
hier versucht man die Differenzierung durch Bildung von zusammengesetzten
Worten, z.B. Hämoglobin (griech. häm Blut). Man trifft auch auf die Buchstaben
des griechischen Alphabets. Dabei bezeichnet α das zuerst Entdeckte und so fort.
Das Häm ist ein Eisen(II)-Porphyrin-Komplex (griech. porphyreos purpur,
rot), mit dem das entsprechende Globulin verbunden ist. Es erteilt dem
Hämoglobin die für das Blut charakteristische Farbe. Es ist, unterstützt duch
gewisse Bereiche des Globulins, verantwortlich für den Sauerstofftransport im
Organismus. Das Häm bezeichnet man wie andere nicht proteinartige Gruppen als
prosthetische Gruppe (griech. prosthetos davor gesetzt). Das Hämoglobin gehört
wie das ähnliche Myoglobin (griech. myos, lat. mus Muskel) zur Gruppe der
Chromoproteide (griech. chromos Farbe). Proteide sind „kleinere" Proteine.
Durch zusammengesetzte Bezeichnungen versucht man eine gewisse Ordnung zu erreichen:
Glykoproteide (griech. glykos süß), enthalten Zucker, Nukleoproteide (lat.
nucleus Kern), Nukleinsäuren. Phosphorproteide, die Phosphorsäurederivate
enthalten, kann man sowohl aus Eidotter als auch aus Casein (lat. caseus Käse)
gewinnen. Wiederum handelt es sich nicht um identische Substanzen im chemischen
Sinne. Schon die Unterscheidung von Albuminen und Globulinen über die
wahrscheinlich kolloide Löslichkeit ist schwierig, d.h. nicht eindeutig.
Die Kristallisation von Proteinen
ist besonders schwierig. Die Kristallisation von Ovalbumin gelang Hofmeister
1890. Die Bestimmung der molaren Massen (Molekulargewicht) mit der
Ultrazentrifuge 1925-1930 durch Th. Svendberg brachten den Nachweis, dass es
sich um Makromoleküle handelt. Vor dem Hintergrund der Schwierigkeiten der
Chemie der Proteine wird der Streit um die organische Chemie -„organisch",
weil man annahm, dass organische Verbindungen zu ihrer Bildung einer
Lebenskraft bedürften- nachvollziehbar. Die Harnstoffsynthese durch Wöhler 1828 hatte die Trennung
von organischer und anorganischer (zunächst unorganischer) Chemie in Frage
gestellt. Harnstoff galt seit seiner Entdeckung 1773 durch Rouelle als
organische Verbindung.
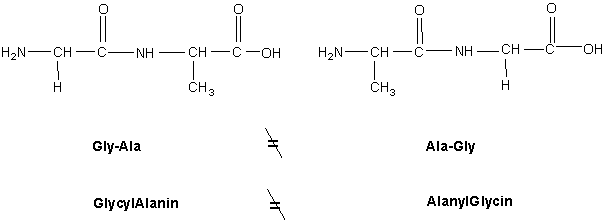
Erst 1875 konnte Schützenberger zeigen, dass das Hydrolysat (griech. hydros Wasser und lysis Auflösung) von Proteinen ausschließlich Aminosäuren einer bestimmten Bauart (Abb. 1) enthält. Auf dieser Grundlage formulierten F. Hofmeister und Emil Fischer 1902 Proteine als Polypeptide (Abb. 2a), d.h. eine durch diese Aminosäuren vorgegebene spezielle Form von Polyamiden. Man schreibt die Aminosäuren als Abkürzung von drei Buchstaben (s. Tab. 1), wobei die N-terminale Aminosäure links steht. Die Reihenfolge oder Sequenz (lat. sequi folgen) der Aminosäuren ist für die Struktur des Peptids entscheidend, wie am Beispiel eines Dipeptids in Abb. 2b gezeigt wird.
Aminosäuren allgemein
Aus der Geschichte der Arbeiten an
Proteinen wird verständlich, dass die Entdeckung der einzelnen natürlichen
Aminosäuren weitgehend erst im Laufe des 19. Jahrhunderts erfolgte. Die Hauptschwierigkeit bestand in der Isolierung;
chromatographische Methoden standen noch nicht zur Verfügung. Die Aminosäuren
wurden in der Regel aus dem saurem Hydrolysat eines Proteins erhalten. Der
Gehalt der verschiedenen Proteine an einzelnen Aminosäuren ist teilweise sehr
unterschiedlich. Eine andere heute industriell genutzte Methode zur Herstellung
von Aminosäuren bedient sich der Biotechnologie. Die Mikroorganismen geben die
Aminosäuren in das Kulturmedium ab, aus dem sie dann gewonnen werden.
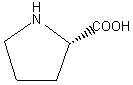
Aus der allgemeinen Formel der natürlichen Aminosäuren (Abb. 1) ist ersichtlich, dass es sich bei
dem α-C-Atom um
ein asymmetrisches C*-Atom, d.h. um ein Chiralitätszentrum handelt. Die
absolute Konfiguration entspricht der S-Form nach der
Cahn-Ingold-Prelog-Definition. Bei der Zuordnung nach Emil Fischer bezeichnete man diese
Form als die L-Form. Die einzige Aminosäure ohne Asymmetriezentrum ist das Glycin
(R=H), das gleichzeitig die einfachste Aminosäure ist.
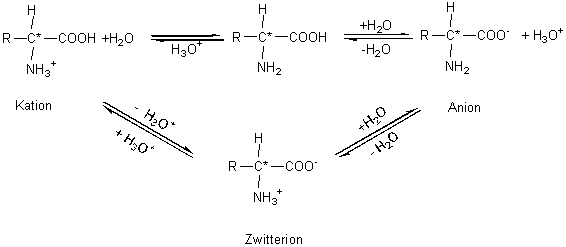
Aminosäuren enthalten im selben Molekül sowohl eine Aminogruppe als auch
eine Carboxylgruppe (Abb. 1). Die
Aminogruppe als Protonenacceptor kann zu einem Kation führen, die
Carboxylgruppe als Protonendonator zu einem Anion. Die Lage der Gleichgewichte
hängt vom pH-Wert der Lösung ab. Bei einem bestimmten pH-Wert liegt das Molekül
sowohl als Anion als auch als Kation vor. Diesen Punkt bezeichnet man als
isoelektrischen Punkt, das dermaßen zweifach verschieden geladene Molekül als
Zwitterion. An diesem Punkt ist die Löslichkeit der Aminosäuren am geringsten.
Der pKS-Wert liegt um ca. 2,5 Einheiten höher als der der Essigsäure. Im
festen Zustand liegen die Aminosäuren als Zwitterionen vor. Wie bei ionischen
Verbindungen zu erwarten, liegen die Schmelzpunkte hoch und sind von Zersetzung
begleitet. Die nicht dissoziierte Form liegt in wäßriger Lösung praktisch nicht
vor.
Einzelne Aminosäuren
Sie haben alle Trivialnamen, die oft Hinweise auf ihre Isolierung oder
auf ihre Eigenschaften geben.
Das Betain (Tab. 4 Nr. 23) ist ein Sonderfall, es liegt eindeutig als
Zwitterion vor. Daher werden Zwitterionen auch als Betaine bezeichnet. Betain
kann von der Struktur her nur Endgruppe eines Polypeptids sein. Das Vorkommen
in der Melasse (lat. mel Honig), eines dunklen Zuckersirups, der bei der
Herstellung des Rübenzuckers (Andreas Marggraf (1709 -
1782)) anfällt, hat zum Namen dieser Substanz geführt: lat. beta Rübe. Betain
ist ein Methylgruppenlieferant bei Transmethylierungsprozessen.
Die erste Aminosäure wurde 1806 aus dem Saft von Spargelpflanzen (lat.
asparagus) von Vauquelin und Robiquet isoliert und Asparagin genannt. (Tab. 1B Nr.
14). Die Asparaginsäure (Tab. 3 Nr. 19)
folgte erst 1968, die Ritthausen in Leguminosenkeimlingen fand. Asparaginsäure
spielt zusammen mit Glutaminsäure eine wichtige Rolle zur Entgiftung des beim
Metabolismus der Aminosäuren entstehenden Ammoniaks im Harnstoff - oder
Ornithincyclus.
Das Musterbeispiel einer Aminosäure aus einem Hydrolysat ist das Glycin (Tab. 1B Nr. 9), das man noch lange Glykokoll
nannte, was Süßleim bedeutet (griech. glykos süß und griech. kolla Leim). Für
die Leimherstellung kochte man tierische Abfälle wie Haut, Ohren, Knorpel und
Sehnen. Auf ähnlichem Weg erhält man auch Gelatine. Aus solchen Hydrolysaten
isolierte 1820 Braconnot das Glycin.
Aus dem Hydrolysat von Menschenhaar isolierte W. C. Rose 1935 das Threonin (Tab. 1B Nr. 11). Zu ihrem Namen kam diese
Aminosäure, weil die beiden asymmetrischen C-Atome die gleiche Konfiguration
zeigten wie im Zucker Threose. Die Oxidation führt zur Weinsäure, der
enantiomere Zucker Erythrose wird zur Mesoweinsäure oxidiert.
Aus Seidenleim isolierte Cramer 1865 das Serin (lat.seres, die heutingen Chinese,
wo die Seide herkam)(Tab. 1B Nr. 10) eine weitere Aminosäure mit einer
alkoholischen OH-Gruppe.
1846 unterwarf Liebig Käse einer KOH-Schmelze und erhielt eine
Aminosäure, die er Tyrosin ((Tab. 1B Nr. 13) nannte (griech. tyros Käse).
Arginin (Tab. 2 Nr. 17) ist seit 1886 bekannt und verdankt
seinen Namen einem schwerlöslichen Silbersalz (argentum Silber). 1866 wurde Glutamin (Tab. 1B Nr. 15) zusammen mit der Glutaminsäure (Tab. 3 Nr. 20) aus dem Gluten (lat. gluten Klebestoff), dem
Kleber des Weizens isoliert. Lysin (Tab. 2 Nr. 16) (griech. lysis Lösung) hat zuerst Drechsel
1899 aus Casein (lat. caseus Käse) erhalten.
Prolin (Tab. 1A Nr. 5) findet sich zusammen mitHydroxyprolin (Tab. 4 Nr. 22)
in vielen Proteinhydrolysaten. Es wurde 1901 von Emil Fischer isoliert.
Leucin (Tab. 1A Nr. 3) hat seinen Namen von den
schimmerden weißen Kristallschuppen (griech. leukos weiß) als die Proust 1819
diese Aminosäure erhielt. Isoleucin(Tab. 1A Nr. 4) (griech isos gleich) fand Ehrlich
1904 in Melasse. Leucin und Isoleucin gelangen mit den Proteinen von
Traubensaft, Getreide oder Kartoffeln in die zu vergärenden Lösungen und werden
bei der alkoholischen Gärung in Gärungs-Amylalkohol (3-Methylbutanol und
2-Methylbutanol) umgewandelt; Amyl-Alkohol, weil man annahm, dass er aus der
Stärke der Kartoffeln (griech. amylon Stärke) stammte. Bei der Destillation
reichern sich diese beiden Alkohole im Rückstand an und gehen dann im Nachlauf
als Fuselöl (lat. fusilis flüssig, geschmolzen) über.
Aus zwei Molekülen Cystein (Tab. 1B Nr. 12) bildet sich durch Oxidation Cystin (Tab. 4 Nr. 21), das durch eine S-S-Bindung charakterisiert ist. Durch solche S-S-Brücken können Peptidketten fest zusammengehalten werden. Lockerer sind die Wasserstoffbrückenbindungen zwischen den einzelnen Peptidketten. Haare, Hufe und Federn sind reich an solchen Schwefelbrücken. Diese Gruppe der Skleroproteine (griech. skleros hart), zu der auch das Bindegewebe zählt, sind außerdem durch eine besondere Struktur gekennzeichnet. Durch Reduktion des bei der Hydrolyse erhaltenen Cystins wird Cystein gebildet, das wiederum leicht reoxidiert wird. Auch bei der Dauerwelle werden zunächst die S-S-Bindungen reduziert und danach wieder oxidiert, so wird die vorgegebene Form (Welle) fixiert. Das Cystin ist sehr schwer löslich und widersteht der Verdauung. Nur eine spezielle Motte (Kleidermotte) verfügt über die Enzyme, um sich von Wolle ernähren zu können. Das antioxidativ wirkende Glutathion ist ein Tripeptid aus Cystein, Glutamin und Glycin: γ-Glu-Cys-Gly (s. Abb. 3), wobei die Bindung der Glutaminsäure über die γCarboxylgruppe statt über die α-Carboxylgruppe ungewöhnlich ist.
In der Hoffnung auf neue Aminosäuren zu stoßen, unterwarf man
ausgefallene, d.h. seltene Proteine der Hydrolyse. So fand Kossel 1896 im
Sturamin, dem Protamin aus Sperma des Störs, das Histidin (Tab. 2 Nr. 18). Aus dieser auch im Hämoglobin
vorhandenen Aminosäure wird durch Decarboxylierung Histamin (griech. histos
Gewebe) gebildet, das die Beschwerden der Allergie auslöst.
Das antioxidative Methionin (Tab. 1A Nr. 8) wurde erst 1921 aufgefunden. Es
ist ein wirksamer Radikalfänger im Organismus. Methionin ist der
Methylgruppenlieferant für Transmethylierungen. Es ist auch die Vorstufe des
Reifungshormons Ethen der Äpfel. Das Spurenelement Selen hat im Selenomethionin
den Platz des Schwefels im Methionin eingenommen.
Phenylalanin (Tab. 1A Nr. 6)
bildet mit Tyrosin s.o. und Tryptophan (Tab. 1A Nr. 7) die Gruppe der aromatischen
Aminosäuren, die für die Xanthoproteinreaktion (griech. xanthos gelb), d.h. die
Gelbfärbung der Haut bei Kontakt mit konzentrierter Salpetersäure,
verantwortlich sind. Phenylalanin wird im Körper zu Tyrosin oxidativ
hydroxyliert. Die Transformation geht weiter über Dopa (Dihydroxyphenylalanin) und Dopamin zu
den Nebennierenhormonen Noradrenalin und Adrenalin. Dopa ist auch die
Vorstufe des Pigments (lat. pigmentum Farbstoff) Melanin (griech. melas
schwarz, dunkel) Das Hypophysenhormon Melatonin und das Gewebehormon Serotonin
werden aus Tryptophan gebildet.
Verdauung und Metabolismus
Verdauung setzt die Aufnahme aus dem Magen-Darm-Trakt voraus und hat die
Verwertung durch den Organismus zum Ziel. Beim Metabolismus (griech. metabole
Umsetzung, Wandel) wird die Umwandlung der aufgenommenen d.h. resorbierten
(lat. resorbere aufnehmen) Substanzen im Organismus untersucht.
Proteine können nicht direkt resorbiert werden, dazu müssen sie zunächst
verdaut werden. Verdauungsenzyme (griech. enzyme Sauerteig) wie z. B. Pepsin
(griech. pepsis Verdauung) und Trypsin sind lange bekannt. Diese Enzyme
arbeiten bei verschiedenen pH-Werten. Pepsin ist eine Endopeptidase, die die
Peptidkette im Magen in der Nachbarschaft von z. B. von Phenylalanin und
Tyrosin in Bruchstücke spaltet. Im Dünndarm werden einzelne Aminosäuren von
Exopeptidasen (Trypsin und Chymotrypsin) von den Enden der Peptidketten her
abgespalten, die dann resorbiert werden können.
Neben der beim Phenylalanin erwähnten Hydroxylierung ist die oxidative
Desaminierung eine wichtige und allgemeine Reaktion. Die entstehenden α-Ketosäuren gehen nach eventuellen
Umwandlungen in den Citronensäurecyclus ein. In Umkehrung können aus αKetosäuren durch reduktive
Transaminierung Aminosäuren gebildet werden.
Ist der Weg von Phenylalanin zu Tyrosin auf Grund des Fehlens des
Enzymsystems blockiert, reichert sich Phenylbrenztraubensäure (α -Ketophenylpropionsäure) an.Diese
Erbkrankheit ist als Phenylketonurie (lat. urina, griech.uron Harn) bekannt und
geht mit irreversiblen Hirnschädigungen einher. Die Diagnose (griech. diagnosis
Unterscheidung Beurteilung) muß möglichst frühzeitig beim Neugeborenen gestellt
werden. Die Behandlung erfolgt mit einer an Phenylalanin armen Diät (griech.
diaita lat. diaeta geregelte Lebensweise).
Essentielle Aminosäuren
Nicht alle Aminosäuren können im menschlichen Organismus gebildet werden und müssen ihm als solche zugeführt werden. Die Ernährungsversuche mit Diäten und entsprechenden Zusätzen gehen auf W. C. Rose (1937) zurück, der mit dem Threonin die erste essentielle d.h. unentbehrliche Aminosäure (lat. essentia Sein, Wesen) fand. Da die Ernährungsversuche nicht immer eindeutig verlaufen und manchmal die körpereigene Bildung einer Aminosäure möglich ist, aber nicht in ausreichendem Maße erfolgt, findet man auch Angaben wie semi-essentiell z.B. bei Arginin und Histidin. In Tab. 5 sind die für den Menschen acht essentiellen oder unverzichtbaren Aminosäuren zusammengestellt. Für die Ratte ist auch Histidin essentiell. Pflanzen und Mikroorganismen können alle Aminosäuren synthetisieren.
|
|
|
|
|
b) Dipeptide
|
|
|
![]()
Tabelle
1
neutrale Aminosäuren
|
unpolare und hydrophobe Aminosäuren |
|||||||||||||||||||||||||||
* für den Menschen
essentiell |
|
Aminosäuren mit polaren Seitengruppen |
||||||||||||||||||||||||
* für den Menschen essentiell |
Tabelle
2
basische Aminosäuren
* für den Menschen essentiell |
|
|
Tabelle
5
essentielle Aminosäuren
|
Isoleucin |
Version française (traduction A.S.Gomez)