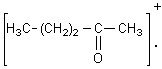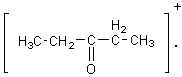SPECTROMETRIE DE MASSE
Principe et rudiments
1) Généralités :
1-1) Aspect d'un spectre de masse :
1-2) A quoi sert-il ?
2) Comment
réalise-t-on un spectre de masse; que signifie-t-il ?
2-1)Première approche en chimie organique :
2-2) Analyse d'un spectre simple :
2-3) Comparaison de spectres :
2-4) Cas des composés carbonylés :
2-5) Cas des alcools :
3) Schéma de
principe d'un spectrographe de masse :
4) Spectromètre de
masse MALDI/TOF
1) Généralités
:
1-1) Aspect d'un spectre
de masse :
1-2)A quoi sert-il ?
- Composés
organiques: Détermination des masses molaires et des formules des molécules
organiques. Il renseigne sur la facilité avec laquelle les liaisons peuvent se
rompre dans la molécule analysée.
- Analyse
qualitative et quantitative d'un mélange gazeux même à faible pression. Un
spectrographe de masse peut se placer en sortie d'un chromatographe en phase
gazeuse, comme détecteur.
- Analyse des
différents isotopes présents dans un gaz.
2) Comment
réalise-t-on un spectre de masse; que signifie-t-il ?
2-1) Première approche en chimie organique :
On soumet le composé
moléculaire, par exemple CH4, porté à l'état gazeux, à un bombardement d'électrons
d'énergie moyenne; certaines molécules éjectent un électron et deviennent des
radicaux CH4+. (ion moléculaire ou ion
parent). Ces radicaux peuvent se fragmenter par rupture de certaines
liaisons et devenir des cations de masse inférieure qui à leur tour peuvent se
fragmenter ....
Ainsi dans
l'exemple du méthane, en plus de l'ion parent on peut obtenir: CH3+; CH2+.;CH+; C+.
Remarque: Les cations
radicalaires sont ceux qui possèdent un nombre impair d'électrons, les autres
en possèdent un nombre pair.
Ces cations
sont ensuite accélérés par un champ
électrique, puis soumis à un champ
magnétique perpendiculaire à leur direction de propagation qui transforme
leur trajectoire rectiligne en trajectoire circulaire. Les
rayons de ces trajectoires dépendent du rapport m/e (m étant leur masse en
unité de masse atomique et e leur charge électrique exprimée en nombre de
charges élémentaires). On peut alors de diverses façons les trier et les
compter et établir un diagramme ("spectre") donnant leur abondance
relative en fonction de leur rapport m/e.
2-2) Analyse d'un spectre simple :
a) On examine le spectre de masse schématisé du méthane:
- en ordonnées, on porte l'abondance relative des ions détectés (100
pour le plus abondant).
- en abscisses, le rapport m/e; comme e vaut 1 (par hypothèse nous ne
considérons que les ions positifs portant une charge élémentaire), ce rapport
est égal à m.
- On s'aperçoit que dans l'exemple choisi, le pic correspondant à l'ion le plus
abondant (100) est celui de masse 16 , c'est-à-dire celui de l'ion moléculaire
CH4+. ou ion parent (sa
masse est pratiquement celle de la molécule car la masse de l'électron perdu
est négligeable).
- Le pic de masse 15 (CH3+) a une abondance relative d'environ 85.
- Le pic de masse 14 (CH2+.) a une abondance relative d'environ 10.
- Le pic de masse 13 (CH+) a une abondance relative d'environ 4.
- Le pic de masse 12 (C .)
a une abondance relative d'environ 1.
b) Définition et remarques :
- Définition: Le
pic correspondant à l'ion le plus abondant est appelé pic de base
. Dans notre exemple il correspond à l'ion parent, mais ce n'est pas
toujours le cas.
- Remarque 1 : La perte d'un atome d'hydrogène fait diminuer la masse
d'une unité (la masse d'un atome d'hydrogène correspond à une unité de masse
atomique).
- Remarque 2 : On voit que la rupture d'une liaison C-H est relativement
aisée (pour 100 CH4+. on trouve 85 CH3+).
- Remarque 3 : Un pic existe à droite du pic de l'ion moléculaire CH4+. Il est dû à l'ion
moléculaire CH4+.mais avec l'isotope
13 du carbone (1 neutron de plus que dans le noyau de l'atome de 12C donc une unité de
masse atomique de plus pour l'ion) qui est un isotope stable du carbone,
existant naturellement (1,1%). Statistiquement il y a 1,1% de CH4 avec 13C, donc 1,1% de CH4+. avec 13C.
- Remarque 4 : Avec le pentane (C5H12) par exemple on trouve que l'ion
parent (masse 72) qui n'est pas le pic de base a une abondance relative
d'environ 10. L'abondance relative de l'ion C5H12+ contenant du 13C se calcule ainsi:
2-3)Comparaison
de spectres :
Observons le spectre de masse du pentane C5H12 (CH3-CH2-CH2-CH2-CH3)
Le pic à m/e =
72 correspond à l'ion parent CH3-CH2-CH2-CH2-CH3.+
Le pic à m/e =
57 correspond à l'ion C4H9+
Le pic à m/e =
43 correspond à l'ion C3H7+ ; c'est le pic de base.
Le pic à m/e =
29 correspond à l'ion C2H5+
Le pic à m/e =
15 correspond à l'ion CH3+
On voit que
toutes les liaisons C-C ont été rompues.
On voit autour
de ces pics, d'autres pics, résultant de la présence du 13C, ainsi que des pics
résultant de la coupure d'une ou plusieurs liaisons C-H.
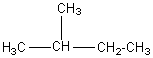
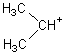
Comparaison avec celui du 2-méthylbutane : l'un des isomères
du pentane
|
|
CH3-CH2-CH2-CH2-CH3 |
|
|
|
On retrouve une fragmentation de
la molécule comparable à celle du pentane, mais les abondances relatives des ions
ne sont pas les mêmes. On voit que les ions relativement les plus abondants
sont pour m = 43 et m = 57 ce qui traduit une rupture plus aisée des liaisons
C-C autour du carbone n°2 qui est le carbone de la molécule le plus
substitué.
L'ion
le plus abondant est 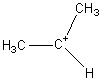 (m=43)
(m=43)
Cela
n'est pas étonnant dans la mesure où l'on sait qu'un carbocation est d'autant
plus stable qu'il est plus ramifié (carbocation (III) plus stable qu'un
carbocation (II) lui-même plus stable qu'un carbocation (I)).
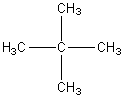
Comparaison
avec celui du 2,2-diméthylpropane: un autre isomère du
pentane.
|
|
|
CH3-CH2-CH2-CH2-CH3 |
|
|
|
|
L' abondance
de l'ion parent diminue encore ; le pic de base devient celui pour lequel m
vaut 57 soit C4H9+ c'est à dire ici
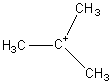 .
.
C'est un carbocation tertiaire, le plus
stable. Le pic m =43 a disparu et par contre on voit un pic à m=41 et on
continue à voir un pic à m= 29 (C2H5+); ceci traduit des réarrangements
complexes des ions formés avec transferts d'atomes d'hydrogène.
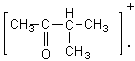
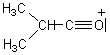
2-4) Cas des composés carbonylés :
Pour les composés carbonylés deux
fragmentations se révèlent importantes, ce sont celles qui se produisent en a du carbone du carbonyle:
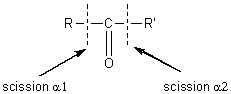
Lors
de la scission a1 à partir de l'ion parent 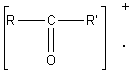 il se
forme préférentiellement le cation acylium
il se
forme préférentiellement le cation acylium ![]() stabilisé par résonance.
stabilisé par résonance.
Lors
de la scission a2 il se forme préférentiellement le cation acylium ![]() .
.
Le
tableau suivant donne les pics principaux que l'on trouve en faisant les
spectres de masse de trois cétones isomères:
- la pentan-2-one
- la pentan-3-one
- la 3-méthylbutan-2-one
|
Molécule |
Pic de l'ion parent |
Pic des ions acylium résultant des scissions a |
Autres pics notables |
Commentaire relatif aux autres pics notables. |
|
Pentan-2-one |
|
m = 71 abondance relative 8
m = 43 abondance relative 100 |
|
Il s'agit d'un réarrangement de
Mac Lafferty. |
|
Pentan-3-one |
|
m = 57 abondance relative 100 |
|
Ces deux cations ont même masse
molaire; ils sont détectés en même temps. |
|
3-méthylbutan-2-one |
|
|
|
L'ion acylium de masse
43 et le carbocation ayant même masse sont détectés en même temps.
L'abondance relative de l'ensemble de ces deux ions est 100. |
Remarque: Lorsqu'un composé carbonylé à un H
placé sur un atome de carbone situé en g
par rapport au carbone du groupement carbonyle et si la chaîne permet à cet
hydrogène de venir assez près de l'oxygène de ce même groupement, il se produit
un réarrangement dit de Mac Lafferty qui
consiste en une scission de l'ion parent en un nouvel ion moléculaire et une
molécule:
Exemple: Avec la
pentan-2-one, par exemple qui satisfait ces conditions, on a:
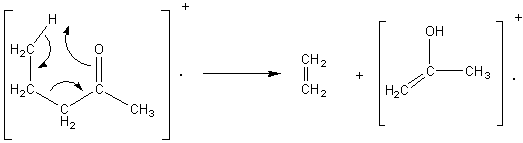
Ni la
pentan-3-one, ni la 3-méthylbutan-2-one ne satisfont ces conditions, le
réarrangement n'a pas lieu.
2-5) Cas des alcools:
-
On constate souvent un pic important à 18 unités de moins que l'ion parent; il
s'agit de la déshydratation facile de l'alcool:
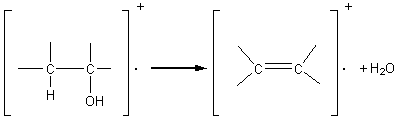
-
Des scissions en a du carbone portant le
OH interviennent aussi fréquemment:

3) Schéma
de principe d'un spectrographe de masse:
Les cations de
masse m de charge électrique e, produits par bombardement des molécules par des
électrons d'énergie voisine de 10 à 12eV, sont accélérés dans un champ
électrique produit par deux plaques métalliques soumises à une différence de
potentiel U, puis leur trajectoire est transformée en cercle par un champ
magnétique d'intensité B. La trajectoire de ces cercles a un rayon que l'on
peut calculer par la formule:
![]()
On voit que le
rayon des cercles dépend du rapport m/e.
Une fenêtre
permet de laisser passer et donc de détecter les ions qui se présentent devant
elle. On peut en jouant sur U ou sur B ou sur les deux à la fois, faire
passer les ions produits dans la chambre d'ionisation devant la fenêtre
par ordre de masse croissante ou décroissante et donc obtenir le spectre de
masse de la molécule analysée.
Remarque:
Il existe
d'autres types de spectrographes, les spectrographes à temps de vol par
exemple; la méthode de dispersion des ions ne fait pas appel à un champ
magnétique; on accélère les ions par brèves impulsions en les soumettant à de
brèves différences de potentiel et ils sortent de la chambre d'accélération
avec des vitesses inégales. On montre que la vitesse d'un ion est reliée à sa masse
par la relation :
![]()
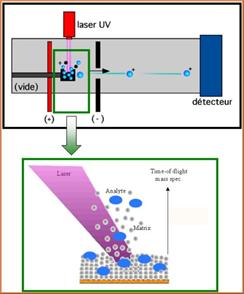
4) Spectromètre de
masse MALDI/TOF (Paragraphe
inspiré par l'article http://cbm.cnrs-orleans.fr/la-recherche-2/plateforme-spectrometrie-de-masse/maldi-tof/2-maldi/)
L'acronyme MALDI/TOF correspond à Matrix
Assisted Laser Desorption Ionisation/Time Of Flight.
La désorption/ionisation laser assistée par
matrice est une technique d'ionisation douce utilisée en spectrométrie de masse
pour analyser de grosses molécules non volatiles ou instables thermiquement.
Elle s'adresse à des biomolécules (ADN,
protéines, peptides, sucres) ainsi qu'à de grandes molécules organiques
synthétiques (polymères et autres macromolécules).
Une matrice et un échantillon sont disposés
sur une cible. Un faisceau laser pulsé dont la longueur d'onde est située dans
la bande d'absorption de la matrice et en dehors de celle de
l'échantillon, vient évaporer la matrice, entraînant avec elle
l'échantillon en phase gazeuse (phénomène de désorption). Les molécules
ionisées de la matrice (généralement acide) transfèrent un proton aux molécules
de l'échantillon.
Les ions sont ensuite analysés avec un
spectromètre à temps de vol (TOF MS) : par des différences de potentiels
appliquées sur des lentilles, les molécules ionisées sont accélérées puis
transférées dans l'analyseur TOF. Cet analyseur va permettre la séparation des
molécules ionisées qui dépendra de leur rapport masse sur charge (m/e).
La matrice
joue 3 rôles :
- Elle réduit les forces
intermoléculaires et favorise la séparation des molécules
- Elle absorbe l'énergie du faisceau
laser, ce qui permet de protéger les molécules cibles.
- Elle favorise l'ionisation des
molécules à analyser en induisant des transferts de protons.
Les
principales matrices :
|
|
|
|
|
|
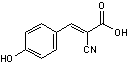
Acide
α-cyano-4-hydroxycinnamique |
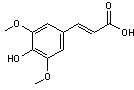
Acide sinapinique |
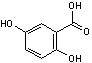
Acide 2,5-dihydroxybenzoïque |
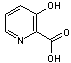
Acide 3-hydroxypicolinique |
|
Pour les
peptides et les protéines. |
Pour les protéines
et les polymères. |
Pour les oligosaccharides, les glycopeptides, les
glycoprotéines et les polymères. |
Pour les oligonucléotides |
Ce spectromètre offre plusieurs avantages
dont la haute résolution, ce qui permet d'accéder à une mesure très exacte de
la masse de la molécule (erreur < 5ppm en étalonnage interne pour une
molécule de 10000 Da) et donc facilite son identification.
C'est une technique d'analyse réservée à des
molécules préalablement purifiées car contrairement aux autres technologies elle
n'est pas couplée à une méthode séparative.
|
|
|
Principe de
fonctionnement de Maldi (Extrait d'un
article publié par le Centre de biophysique moléculaire du CNRS) |