PREPARATION DE L'ACETANILIDE
(CORRIGE DU COMPTE-RENDU)
OBSERVATIONS:
- Aniline
dans l'eau: On remarque de grosses bulles rouges, qui se divisent en
petites gouttes lorsqu'on agite, mais qui ne se dissolvent pas...L'aniline
n'est pas très soluble dans l'eau.
- On
ajoute de l'acide chlorhydrique..Les petites
gouttes disparaissent et l'on obtient une solution homogène légèrement
rouge...En milieu acide fort, l'aniline est beaucoup plus soluble.
L'aniline, pas très soluble dans l'eau, donne, en
réagissant sur les ions oxonium selon l'équation :
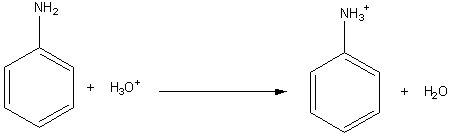
sa base conjuguée qui est, elle, soluble dans l'eau.
- Après
traitement au noir animal à chaud et filtration, la solution obtenue est
incolore...Le noir animal a retenu les impuretés colorées.
- Après
addition de l'anhydride acétique, qui est le second réactif, rien ne semble
se passer et pourtant l'acétanilide est déjà formée...En milieu très acide,
l'acétanilide reste en solution.
- On
ajoute de l'acétate de sodium et tout précipite...L'acétate de sodium a
modifié le milieu et a permis la précipitation du produit préparé.
L'acétate de sodium en présence d'acide acétique
donne une solution tampon dont le pH (4,8) permet la précipitation de
l'acétanilide.
- Recristallisation:
L'utilisation de l'eau comme solvant de recristallisation montre que
l'acétanilide n'est pas très soluble dans l'eau froide et au contraire très
soluble dans l'eau chaude. Les impuretés à éliminer au contraire (acides, ions
acétate) sont très solubles dans l'eau à chaud et à froid.
PARTIE QUANTITATIVE:
Calcul du rendement de la préparation:
1) Equation de la réaction:
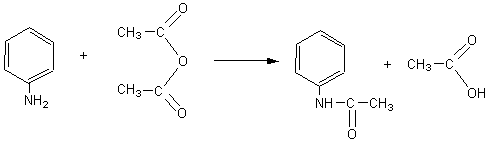
2) Tableau des réactifs:
|
Réactifs |
Etat physique |
Pureté |
Densité |
Masse molaire |
Masse ou volume
utilisé |
Quantité de matière |
|
Aniline |
liquide |
98% |
1,02 |
93 |
10mL |
(10x98x1,02)/(100x93) = 0,107 |
|
Anhydride acétique |
liquide |
98% |
1,08 |
102 |
13mL |
(13x98x1,08)/(100x102) = 0,135 |
Réactif limitant :
L'équation nous montre que les réactifs réagissent mole à mole. C'est donc le
réactif qui au départ intervient avec la plus petite quantité de matière qui
sera le réactif limitant.
C'est l'aniline qui sera le réactif limitant.
Une mole de réactif limitant conduisant à une mole de produit préparé,
la quantité théorique d'acétanilide sera nth =
0,107mole.
Masse
théorique d'acétanilide:
mth=nthxM = 0,107x 135,17 = 14,5g
3) Rendement:
Désignation des masses de produit
obtenues :
m est la masse totale de produit brut humide obtenu.
m1est la masse de
produit brut humide qui a été purifié par recristallisation.
m2 est la masse de produit
recristallisé sec.
a) Rendement de la purification:
Rp = m2/m1
b) Rendement de la synthèse :
Rs = (m2xm)/(m1xmth)