PREPARATION DE L'ACIDE
BENZOÏQUE
Par oxydation de l'alcool benzylique
COMPTE-RENDU
1)
Ecrire l'équation bilan de la réaction d'oxydation (il se forme du dioxyde de
manganèse MnO2; on fera intervenir les ions HO- et
la forme prédominante de l'acide benzoïque dans ce milieu).
2) Calcul
du rendement de la préparation :
2-1) Déterminer les quantités de
matière de tous les réactifs introduits;sachant que 3
moles d'alcool benzylique réagissent avec 4 moles de permanganate de potassium
en déduire la masse théorique d'acide benzoïque attendue.
2-2) Calculer le rendement de la
préparation.
3) Questions sur le mode opératoire:
3-1) Justifier le rôle de
l'éthanol à la fin de la réaction d'oxydation.
3-2) Préciser le contenu du
filtrat et la nature du précipité lors de la filtration du mélange réactionnel.
3-3) Justifier le rôle de l'acide
chlorhydrique pour l'obtention du produit brut.
3-4) Expliquer la nécessité de
refroidir le milieu réactionnel en dessous de 10°C, puis de laver avec de
l'eau froide.
4) Contrôle de pureté:
4-1) Interpréter le
chromatogramme: en déduire la pureté du produit préparé.
4-2) Calculer les Rf .
5) Spectroscopie infra-rouge:
5-1) Identifier, sur les spectres
IR fournis, les bandes caractéristiques des vibrations de valence des
principaux groupements fonctionnels de l'alcool benzylique et de l'acide
benzoïque.
5-2) A l'aide de ces deux
spectres, en déduire si l'acide benzoïque alors analysé par IR contient des
traces de produit secondaire ou d'alcool benzylique non encore oxydé.
Acide benzoïque
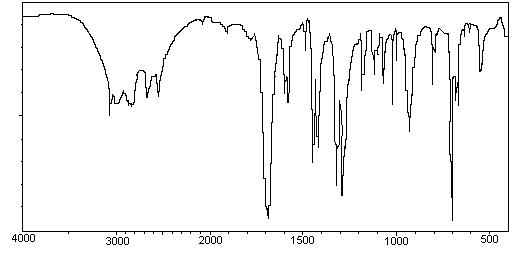
Alcool
benzylique