PRÉPARATION DE
LA 4-NITROANILINE
(CORRECTION DU COMPTE-RENDU)
RETOUR
AU SOMMAIRE
1)
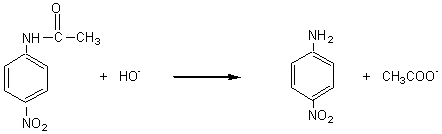
Réaction
d'hydrolyse basique du 4-Nitroacétanilide:
2)
Calcul
du rendement de la préparation:
2-1) Tableau des réactifs:
|
Réactifs
|
Pureté
|
Etat physique
|
Densité
|
Masse molaire
g.mol-1
|
Masse ou volume utilisé
|
Quantité de
matière
(mol)
|
4-Nitroacétanilide
C8H8O3N2
|
98%
|
Solide
|
-
|
180,2
|
9g
|
n1
= (9x98)/(100x180,2) = 4,9x10-2
|
Hydroxyde de sodium
(Soude)
|
100%
|
Solution
|
Concentration:
2,5 mol.L-1
|
-
|
40mL
|
n2
=10x10-2=0,1
|
Réactif
limitant:
L'équation
nous montre que les réactifs réagissent mole à mole.
C'est donc le réactif qui au départ intervient avec la plus
petite quantité de matière qui sera le réactif limitant.
C'est
le 4-Nitroacétanilide qui sera le réactif limitant.
Une
mole de réactif limitant conduisant à une mole de produit
préparé,
la
quantité théorique de 4-Nitroaniline sera nth=
4,9x10-2mole.
Masse théorique
de 4-Nitroaniline:
mth=nthxM
= 4,9x10-2x
138,1 = 6,8g
2-2) Rendements:
Rappelons
la désignation des masses de produit obtenues ou utilisées:
m
est la masse totale de produit brut humide obtenu.
m2est
la masse de produit brut humide qui a été purifié
par recristallisation.
m'2est
la masse de produit recristallisé sec.
a) Rendement de la purification:

b) Rendement
de la synthèse :
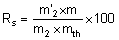
3)
Questions
sur le mode opératoire:
3-1) Le rôle de l'acide chlorhydrique est de réagir avec les
ions HO- du milieu (milieu basique, la soude est en excès):

3-2) A pH<7 la 4-nitroaniline réagirait avec les ions H3O+
du milieu pour donner son acide conjugué:
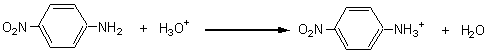
Conséquence:
La 4-nitroaniline est peu soluble dans l'eau. Son acide conjugué
est très soluble dans l'eau à froid. On obtiendrait donc
peu de précipité et le rendement serait très faible.
3-3) On refroidit au dessous de 10°C pour diminuer la solubilité
de la 4-nitroaniline dans l'eau, donc obtenir plus de précipité
et par là augmenter le rendement.
3-4) Le lavage à l'eau permet d'éliminer les composés
formés lors de la réaction de l'acide chlorhydrique sur la
soude (ions spectateurs Na+ et Cl-), ainsi que l'acide éthanoique
formé lors de la réaction principale (CH3COO-
transformé en CH3COOH par action de l'acide chlorhydrique). L'eau
de lavage doit être froide pour dissoudre le minimum de produit préparé.
3-5) Un solvant de recristallisation doit pouvoir dissoudre le produit
préparé (celui que l'on purifie), ainsi que les impuretés
qu'il contient, à chaud. Il ne doit dissoudre à froid que
les impuretés. Ainsi à froid seul le produit préparé
débarrassé de ses impuretés précipitera. Il
ne doit pas réagir avec le produit préparé.
3-6) Lorsqu'un solvant unique ne peut être trouvé pour la
purification du produit brut par recristallisation, on choisit un mélange
de deux solvants. Ici l'eau ne convient pas parfaitement car le produit
de départ (4-nitroacétanilide) est peu soluble dans l'eau
à chaud et à froid. Comme c'est l'impureté à
éliminer, il faut augmenter sa solubilité dans le solvant,
on ajoute donc de l'éthanol. Cela va augmenter aussi, la solubilité
du produit préparé, à chaud.
L'éthanol
étant volatil, inflammable et nocif, il faut utiliser un montage
à reflux.
3-7) Dans le gâteau: 4-nitroaniline (produit préparé).
Dans
le filtrat: 4-nitroacétanilide, traces de 4-nitroaniline, eau et
éthanol.
4)
Contrôles
de pureté:
4-1) CCM
4-2) La recristallisation a permis d'éliminer les traces de 4-Nitroacétanilide
éventuellement encore présentes dans le produit brut.
5) Spectroscopie IR:
L'examen du spectre IR fait
apparaître :
- 2 bandes d'absorption à environ 3380 et 3500 cm-1
qui correspondent aux vibrations symétriques et asymétriques
des 2H liés à l'azote dans le spectre de la 4-Nitroaniline.
- 2 bandes d'absorption vers 1500 cm-1et vers 1300 cm-1
qui correspondent aux vibrations du N=O.
6) Résultats obtenus
lors d'une préparation:
| Masse de produit brut humide |
m = 4,0g |
| Masse de produit brut mis
à sécher |
m1
= 2,0g |
| Masse de produit brut mis
à recristalliser |
m2
= 2,0g |
| Volume d'éthanol
utilisé |
V = 5mL |
| Volume d'eau utilisé |
V' = 10mL |
| Masse de produit brut sec |
m'1
= 3,4g |
| Masse de produit recristallisé
sec |
m'2
= 1,4g |
| Rendement de la purification |
R1
= 70% |
| Rendement de la synthèse |
R2
= 82% |
| Température de fusion
du produit recristallisé |
Tf
= 147°C |
RETOUR
AU COMPTE-RENDU

