PRÉPARATION DE
L'ETHYLISOEUGÉNOL
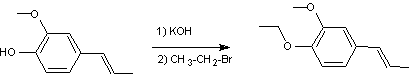
L'éthylisoeugénol est préparé par une réaction de Williamson à partir d'isoeugénol : l'isoeugénol est
d'abord déprotoné par de l'hydroxyde de potassium
puis réagit avec le bromoéthane.
1) Données
:
Isoeugénol
M =
164,2 g.mol-1
d =
1,09
Teb= 266 °C
Pureté
(en masse) : 99 %
Très
peu soluble dans l'eau, très soluble dans l’éthanol, l’éther, le cyclohexane.
Nocif
par ingestion.
Hydroxyde
de potassium
M =
56,1 g.mol-1
Très
soluble dans l’eau.
Nocif
par ingestion. Provoque de graves brûlures.
Bromoéthane
M =
109,0 g.mol-1
d =
1,46
Teb= 38 °C
Moyennement
soluble dans l'eau, soluble dans l'éthanol, le cylohexane.
Facilement
inflammable, très nocif par inhalation et par ingestion.
Éthylisoeugénol
M =
192,2 g.mol-1
Tfus à déterminer < 80
°C
Très
peu soluble dans l'eau. Soluble dans l'éthanol, l'éther, le cyclohexane.
Cyclohexane
M = 184,2 g.mol-1
d = 1,09
Teb= 81 °C
Facilement
inflammable, irritant pour la peau, très toxique pour les organismes
aquatiques. L'inhalation des vapeurs peut provoquer somnolence et vertige.
Éther
diéthylique (ethoxyéthane)
d= 0,71
Teb = 35 °C
Extrêmement
inflammable ; peut former des peroxydes explosifs.
L'inhalation
des vapeurs peut provoquer somnolence et vertiges.
Éthanol
Teb = 76 °C
Soluble
dans l'eau.
Facilement
inflammable.
Éther
de pétrole
(fraction
80 – 110)
Facilement
inflammable, nocif par ingestion, toxique pour les organismes aquatiques.
2) Mode
opératoire
2-1) Synthèse
· Dans
un tricol de 250 mL
surmonté d'un réfrigérant, muni d'un système d'agitation efficace et d'une
ampoule de coulée isobare, ajouter la solution de 4,0 g d'hydroxyde de
potassium dans 8 mL d'eau fournie.
·
Ajouter 9,3 mL d'isoeugénol.
Le mélange prend en masse. Chauffer jusqu'à redissolution.
·
Additionner alors, en 10 min, 11 mL de bromoéthane. Chauffer à reflux pendant 45 min.
2-2) Extraction du milieu
réactionnel
·
Attendre la fin du reflux et introduire 50 mL d'eau
dans le ballon, en agitant efficacement, par le haut du réfrigérant.
·
Transvaser le contenu du ballon dans une ampoule à décanter et extraire l'éthylisoeugénol avec 3 fois 30 mL
de cylohexane.
·
Réunir les phases organiques dans un ballon pour la distillation.
2-3) Cristallisation
·
Éliminer le cyclohexane par distillation. Noter la température de passage des
vapeurs.
·
Lorsque la quasi totalité du cyclohexane est évaporée, arrêter la distillation
et verser en agitant vigoureusement le contenu du ballon encore tiède dans 30 mL d’eau glacée. L'éthylisoeugénol
précipite.
·
Refroidir 10 min dans l’eau glacée sans cesser d’agiter puis filtrer sous
pression réduite. Essorer soigneusement.
· Peser
le produit brut obtenu (masse m). Sécher une masse m1
d’environ 1 g à l'étuve à 30 °C. Conserver le reste (masse m2)
pour la recristallisation.
2-4) Purification
·
Recristalliser la masse m2 g d'isoeugénol
dans un mélange ethanol / eau (4/1) fourni.
·
Filtrer, sécher puis peser le produit purifié obtenu.
2-5) Contrôle de pureté
·
Déterminer la température de fusion du produit purifié.
·
Réaliser une C.C.M. sur gel de silice. Faire les trois dépôts suivants, dans
l’ordre :
_ isoeugénol de référence en
solution à 1 % dans l’éthanol (fourni)
_
produit brut en solution à 1 % dans l’éthanol (à préparer)
_
produit purifié en solution à 1 % dans l’éthanol (à préparer)
Éluer
avec un mélange éther diéthylique / éther de pétrole
(1/1)
Révéler
sous UV à 254 nm.
3) Compte
rendu
Compléter
la feuille de résultats.
3-1) Équations de réaction
Écrire
l'équation de la réaction de l'isoeugénol avec
l'hydroxyde de potassium puis l’équation de la réaction avec le bromoéthane.
3-2) Calcul du rendement de la
préparation
3-2-1) Déterminer, en justifiant
les calculs, les quantités de matière des réactifs introduits puis en déduire
la masse théorique d’ethyl-isoeugénol
attendue.
3-2-2) Exprimer et
calculer le rendement de la préparation en produit purifié et le rendement de
la recristallisation.
3-3) Questions sur le mode
opératoire
3-3-1) Lors de
l'extraction par le cyclohexane, préciser le contenu des deux phases. Justifier
le choix du cyclohexane comme solvant d'extraction. Quel autre solvant
aurait-on pu choisir ?
3-3-2) De quelle manière
peut-on repérer que la distillation du cyclohexane est terminée ?
3-3-3) L'ethylisoeugénol est un solide. Pourquoi le contenu du
ballon à l'issu de la distillation est-il constitué d'une phase huileuse ?
3-3-4) Préciser les
caractéristiques d'un solvant de recristallisation. Justifier le choix du
solvant utilisé ici.
4) Contrôles
de pureté.
4-1) Interpréter le chromatogramme
fourni.
4-2) Conclure sur l'efficacité de la
recristallisation
5) Spectroscopie
infrarouge.
Repérer
sur le spectres IR fourni, les bandes caractéristiques
de l'isoeugénol.
Spectre
IR de
l’isoeugénol
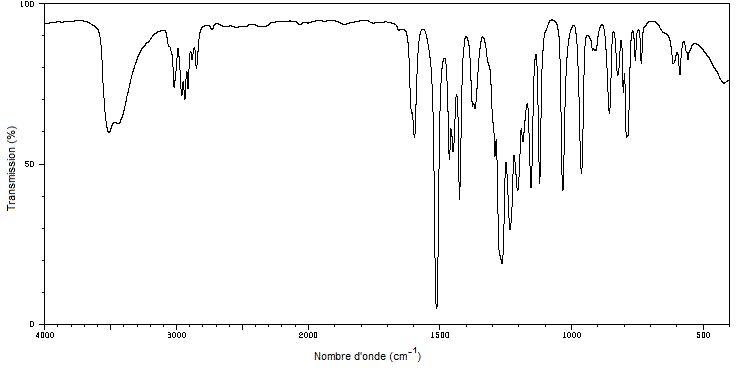
Feuille
de résultats
:
Température
de passage des vapeurs t =
Masse
de produit brut humide : m =
Masse
de produit brut humide mis à sécher : m1 =
Masse
de produit brut sec : m’1 =
Masse
de produit brut humide mis à recristalliser m2 =
Volume de
mélange M utilisé pour la recristallisation : V =
Masse
de produit purifié sec : m’2 =
Rendement
de la purification : Rp =
Rendement
de la synthèse : Rs =
Température
de fusion du produit purifié : Tf =
Chromatogramme
fourni
:
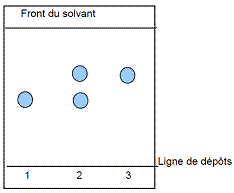
Dépôt
n°1 : isoeugénol de référence
Dépôt
n°2 : éthylisoeugénol brut
Dépôt
n°3 : éthylisoeugénol purifié
Joindre
la plaque de CCM obtenue.