TP STEREOCHIMIE ET ISOMERIE
RETOUR AU SOMMAIRE
1) But
:
Cette manipulation a pour objectif de mieux faire connaître la structure des
molécules les plus courantes rencontrées en chimie organique à partir de
quelques exemples.
2) Matériel :
Une boite de " modèles moléculaires ".
Les modèles sont une représentation, à l'échelle, des atomes et des liaisons.
Ils permettent de construire les principales molécules organiques, de
visualiser les différentes fonctions, les divers isomères et stéréoisomères.
Il est possible de réaliser des modèles éclatés ou des modèles compacts. Sous
la forme éclatée, les distances et les angles de valence apparaissent. Ce type
de représentation permet de visualiser aussi les problèmes de stéréoisomérie, d'encombrement stérique et de conformation.
3 Quelques
représentations préliminaires :
|
Rappels
de définitions:
Formules de constitution.
(Exercice 1)
Une formule de constitution, montre les atomes
liés les uns aux autres par des tirets représentant les liaisons sans se
préoccuper de leurs positions relatives dans l'espace.
Cette formule donne une représentation dans le
plan d'où son nom de formule développée plane.
Il est possible de s'appuyer sur une telle
représentation pour rendre compte de certaines isoméries.
Remarque : les formules de constitution sont à la base de la nomenclature
systématique.
Stéréochimie.
La stéréochimie a pour objet l’étude des
caractéristiques géométriques des molécules, c'est à dire de la façon dont
les atomes sont disposés les uns par rapport aux autres dans l'espace. On
peut déduire de cette disposition les répercussions éventuelles sur les
comportements physique et chimique de ces molécules.
Carbone asymétrique. (Exercice
2)
Il s’agit d'un atome de carbone lié tétraédriquement à quatre atomes ou groupes d’atomes
différents.
|
Exercice d'application 1 :
Représenter les formules développées planes, semi-développées, topologiques et
moléculaires (brutes) des molécules de butane et de 2-méthyl
propane.
Exercice d'application 2 :
Représenter la formule semi-développée de la molécule d'acide lactique (ou
acide 2-hydroxypropanoïque). Repérer l'atome de
carbone asymétrique par un astérisque C*.
|
Rappels
de définitions:
Isomérie.
C’est le caractère des corps isomères. Les
corps isomères sont formés des mêmes éléments dans les mêmes proportions
(même formule brute) mais disposés différemment dans la molécule (formules
développées différentes).
On distingue plusieurs types d’isoméries :
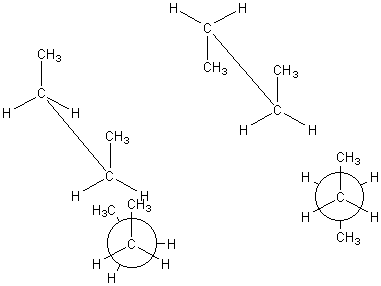
Isomérie structurale. (Exercices 1 et 3)
Isomérie de chaîne (ou de
squelette):
Des isomères de chaîne diffèrent par la
structure de leur chaîne carbonée.
Isomérie de position. (Exercice
4)
Les groupements fonctionnels sont identiques
mais occupent des positions différentes sur la chaîne carbonée. Pour passer d'un
isomère à un autre, il faut démonter une portion de la molécule pour la
retirer et la fixer à un autre endroit de la molécule.
Les isomères de position auront des propriétés
physiques différentes mais des propriétés chimiques voisines.
Isomérie de fonction. (Exercice 5)
A partir des mêmes atomes il est possible de
former des groupements fonctionnels différents. Les molécules ainsi formées
présenteront des propriétés physiques et chimiques différentes.
Conformations : (Exercice 7)
Pour une molécule donnée on peut passer d'une
conformation à une autre par rotation (ou torsion) autour d'une simple
liaison. Les chaînes peuvent donc prendre une infinité de conformations.
Conformations des dérivés de l'éthane. (Les
conformations les plus stables sont celles dans lesquelles les autres
liaisons des atomes de carbone sont en positions décalées ; celles dans
lesquelles elles sont en positions éclipsées sont les moins stables.)
Conformations chaise
et bateau du
cyclohexane.
Conformations axiale et équatoriale des substituants d'un cycle.
Le passage d'une conformation à une autre est
rapide à température ordinaire ; il existe un équilibre conformationnel.
Les isomères conformationnels ne sont pas
isolables.
Configurations.
On ne peut pas passer d'une configuration à une
autre par des rotations autour de simples liaisons. Il est nécessaire de
briser des liaisons pour réorganiser l'agencement de la molécule.
Configurations Z et E pour les composés
éthyléniques.
Configurations cis et trans pour les molécules cycliques substituées sur le
cycle.
Configurations R et S ou D et L pour les
composés possédant un carbone asymétrique.
|
Exercice d’application 3
:
Représenter et nommer les différents isomères dont la formule moléculaire brute
est : C5H12.
Représenter et nommer les trois isomères du diméthylbenzène.
Exercice d’application 4 :
Représenter les formules semi-développées des molécules suivantes :
But-1-ène et but-2-ène.
Propan-1-ol et propan-2-ol.
Exercice d’application 5
:
Représenter les formules semi-développées des molécules d’acide butanoïque et d'éthanoate d'éthyle. Donner la formule
moléculaire brute de ces deux corps. Faire ressortir les deux fonctions
organiques présentes et les nommer.
|
Rappels
de définitions:
Isomérie optique.
Elle concerne les substances qui ont pour
propriétés de dévier, à droite ou à gauche, le plan de polarisation de la
lumière polarisée. On dit de ces substances qu’elles
sont optiquement actives.
Principe de Pasteur : l'isomérie optique est
due à une dissymétrie de la molécule, c'est à dire à un arrangement des
atomes dans l'espace, tel qu'il ne soit pas superposable à l'image qu'en
donne un miroir plan.
L'isomérie optique se rencontre principalement
parmi les substances possédant un ou plusieurs atomes de carbone
asymétriques.
Si un observateur placé en face du rayon
lumineux voit le plan de polarisation de la lumière dévié vers la droite la
substance est dite dextrogyre (d ou +). Si elle est déviée vers la gauche
elle est dite lévogyre (l ou -).
Chiralité.
Une molécule non superposable à son image dans
un miroir plan est chirale.
Une molécule chirale ayant un carbone
asymétrique:
Est optiquement active (elle possède un pouvoir
rotatoire).
Existe sous deux formes énantiomères.
Enantiomérie
Deux molécules énantiomères sont symétriques l'une
de l’autre par rapport à un plan (ou image l'une de l'autre dans un
miroir) ; elles sont identiques dans toutes leurs propriétés sauf le signe du
pouvoir rotatoire.
Le mélange en proportions égales des deux
énantiomères est le racémique, optiquement inactif.
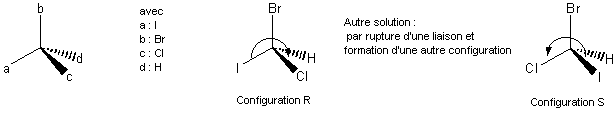
Configuration absolue:
(Exercice 6)
Chacune des deux configurations d’un
carbone asymétrique peut être désignée par l’un des symboles R ou S,
suivant les règles de Cahn-Ingold-Prelog.
Considérons un carbone asymétrique C* lié à quatre
groupements a, b, c et d.
Les quatre groupements sont considérés dans l’ordre
décroissant du numéro atomique du carbone directement lié au C*.
Ce classement donne : a>b>c>d.
On regarde la molécule dans l’axe de la
liaison C*-d , de C* vers d.
Si la distribution de abc se fait en tournant
vers la droite, le carbone est appelé R (rectus).
Dans le cas contraire, il est appelé S (sinister).
Lorsque au moins deux des groupements sont liés
au C* par des atomes identiques, on se réfère, pour les classer, aux substituants qu’ils
portent. On compare les numéros atomiques de l’atome le plus "
lourd " de chaque groupe pour conclure.
En cas d’égalité on se reporte sur l’atome
suivant et ainsi de suite.
Diastéréoisomères.
(Exercice 8)
Deux molécules stéréoisomères
qui ne sont pas énantiomères mais qui sont des stéréoisomères
de configuration sont des diastéréoisomères.
C’est le cas des couples Z et E.
Il en est de même des couples formés lorsque
deux carbones asymétriques sont présents dans une molécule.
Les couples dans lesquels les C* de la
molécule sont :
RR et SR ou RR et RS ou SS et SR ou SS et RS
sont des diastéréoisomères.
Remarque : les couples RR et SS d’une part et RS et SR d’autre part
ne sont pas des diastéréoisomères mais des
énantiomères.
|
Exercice d’application 6
: Représenter les deux configurations (R et S) du butan-2-ol.
4) Utilisation des modèles
moléculaires :
|
Quelques
rappels:
L'élément carbone C a pour numéro atomique Z=6. La répartition
électronique est telle que deux électrons se trouvent sur le premier niveau
énergétique et quatre sur le second niveau. Lorsque cet atome se trouve
engagé dans une molécule il peut se comporter de différentes façons en
donnant des orbitales hybrides (sp3 ; sp2 et sp).
Le carbone saturé ou tétraédrique.
Pour représenter le carbone tétraédrique
(hybridé sp3) on utilise de façon habituelle une représentation dite
perspective (de CRAM) très pratique.
Cet atome de carbone a ses quatre valences ou
liaisons dirigées. Les angles de valence sont tous égaux ; deux liaisons font
entre elles un angle de 109°28’.
Les quatre valences du carbone sont donc
orientées vers les sommets d'un tétraèdre régulier dont il occuperait le
centre ; il est dit tétragonal.
Dans une chaîne carbonée il y a libre rotation
autour de la liaison carbone carbone.
Le carbone insaturé,
doublement lié ou éthylénique. (Exercice 8)
Le carbone doublement lié n'est plus tétraédrique
mais il est dit trigonal. La molécule est plane et les angles de valence sont
tous égaux. Deux liaisons font entre elles un angle de 120°.
Remarque : la présence de la double liaison
supprime la possibilité de rotation autour de la double liaison. Cette
rigidité de rotation autour de la double liaison entraînera un nouveau type d’isomérie,
l'isomérie Z et E.
Dans l'isomérie Z les groupements les plus
volumineux sont du même côté de la double liaison ; dans l'isomérie E ils
sont de part et d'autre de la double liaison.

Le carbone triplement lié ou acétylénique. (Exercice 9)
Le carbone triplement lié possède une liaison
triple et une simple liaison dans le prolongement l’une de l’autre.
Deux liaisons font entre elles un angle de 180°. La molécule est linéaire. Le
carbone est dit digonal.
|
Exercice 7:
Construire le modèle de la molécule d'éthane (représentaton
éclatée). Remarquer la liberté de rotation autour de la liaison carbone carbone : elle permet de mettre en évidence les différents conformations.
Exercice 8:
Construire le modèle moléculaire de la molécule d'éthène
(ou éthylène).
Construire le modèle moléculaire des deux isomères Z et E du but-2-ène.
Exercice 9:
Construire le modèle moléculaire de la molécule d'éthyne
(ou acétylène).
La présence de la triple liaison bloque-t-elle la liberté de rotation autour de
l'axe carbone-carbone ?
|
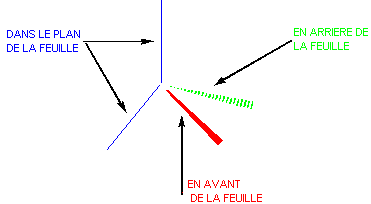
Rappels:
Deux types de représentations sont utilisées ci-dessous la "perspective
cavalière " et la " projection de Newman ".
Dans la projection de Newman l'observateur regarde dans l’axe de la
liaison C-C il voit l'atome de carbone situé à l'avant (figuré par le cercle)
et ses substituants et l'atome de carbone situé à l'arrière
caché par le premier et ne représente que les substituants.
Il existe
un moyen commode de représenter les molécules chirales : c’est la projection de Fischer
utilisée essentiellement dans le cas des acides aminés et des sucres.
Les règles de représentation sont :
la molécule est représentée par une croix, l’atome
de carbone asymétrique étant le point d’intersection des deux branches ;
les lignes horizontales signifient des liaisons
dirigées vers l’avant, les lignes verticales correspondent à des
liaisons dirigées vers l’arrière.
La molécule doit être disposée de façon à ce
que la chaîne principale soit verticale, l’atome de carbone le "
plus lourd " étant en haut.
Dans le cas de l’alanine la représentation
de Fischer donne :
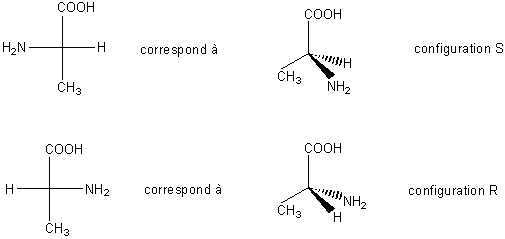
On utilise encore couramment une ancienne nomenclature Série D et L.
Cette nomenclature repère la position du groupe
amino NH2 sur la projection de Fischer.
Si ce groupe est à droite la molécule est dite D ; s'il est à gauche elle est
dite L.
Dans l’exemple représenté ci-dessus la
configuration S correspond à la (L)-alanine.
Remarque : ces notations D et L ne doivent pas être confondues avec les
substances dextrogyres et lévogyres notées d et l.
|
Exercice 10:
- Isomérie de structure, Isomérie de chaîne:
Construire la molécule de butane et du 2-méthyl propane.Les comparer.
- Isomérie de position:
Sur la molécule de butane (on conservera son squelette carboné) remplacer un
hydrogène par un radical hydroxyle pour obtenir un alcool.
Combien d'alcools isomères peut-on réaliser ? Représenter, nommer et donner la
classe de chacun de ces alcools.
- Isomérie de fonction.
Construire la molécule d'éthanol puis celle de méthoxyméthane
(éther méthylique).Les comparer.
- Stéréoisomérie de conformation.
Construire les deux conformations particulières du butane : éclipsée et
décalée.
- Isomérie géométrique Z . E.
Construire la molécule de pent-2-ène.
Combien d'isomères peut-on réaliser ? Ce type d'isomérie existe-t-il dans le
cas de la molécule de but-1-ène ?
- Isomérie optique - Enantiomérie.
Après avoir repéré le carbone asymétrique construire, représenter et nommer les
deux énantiomères de l'acide lactique (acide 2-hydroxypropanoïque).
Exercice 11:
Construction de différentes fonctions organiques oxygénées:
Dans chaque cas construire le modèle moléculaire de la molécule proposée et la
représenter sur le compte-rendu:
- Alcools :
Primaire : éthanol.
Secondaire : propan-2-ol
Tertiaire : 2 méthyl propan-2ol.
- Aldéhyde : éthanal.
- Cétone : propanone.
- Acide carboxylique : acide éthanoïque.
- Ester : éthanoate d'éthyle.
- Chlorure d’acyle : chlorure d'éthanoyle.
Exercice 12:
Construction de différentes fonctions organiques azotées:
-Amines aliphatiques :
Primaire : butanamine.
Secondaire : N-méthylpropanamine.
Tertiaire : N,N-diméthyléthanamine.




