OXYDES
D’AZOTE
Wolfgang
Werner, Münster
« Oxydes
d’azote » est une appellation générale de même que la formule NOx
sans préciser duquel des 6 oxydes d’azote connus (voir Tableau 1) il
s’agit. La valence de l’azote peut varier de +1 à +5.
|
Valence de l’azote |
Formule |
Appellation |
État |
|
|
+1 |
N2O |
Protoxyde d’azote (gaz
hilarant) |
|
gazeux |
|
+2 |
NO |
Monoxyde d’azote |
Réaction rapide
avec des traces d’O2 ; on
obtient NO2 |
gazeux |
|
+3 |
N2O3 |
Trioxyde de diazote |
Anhydride de l’acide nitreux |
gazeux |
|
+4 |
NO2 |
Dioxyde d’azote |
Anhydride mixte d’acide nitreux et d’acide nitrique
(dismutation) |
Gazeux (roux) |
|
+4 |
N2O4 |
Tétroxyde de diazote |
Anhydride mixte d’acide nitreux et d’acide nitrique (dismutation) |
Liquide jaune (20°C) |
|
+5 |
N2O5 |
Pentoxyde de diazote |
Anhydride de l’acide nitrique |
solide (incolore) |
Les oxydes d’azote sont des
composés endothermiques qui ne se forment qu’avec l’apport d’énergie. Dans
l’atmosphère, dans l’air, l’azote (78%) et
l’oxygène (21%) coexistent
dans les conditions normales (1 atmosphère de pression et une température de
20°C) sans qu’une réaction ne soit observée.
Des oxydes d’azote simples à l’acide nitrique
À la
température de l’arc électrique, d’environ 3000° C, se forme du monoxyde
d’azote NO qui réagit rapidement avec de l’oxygène pour donner du dioxyde
d’azote NO2 de couleur rousse qui, à son tour, se dimérise en
tétroxyde de diazote N2O4 incolore.
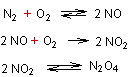
En 1903 Birkeland (Professeur de physique à Oslo) et
Eyde ont développé à partir de cette
synthèse du monoxyde d’azote la production industrielle de l’acide nitrique.
Dans l’eau le dioxyde d’azote donne avec de l’oxygène de l’acide nitrique.
![]()
Cette synthèse de l’acide nitrique ne pouvait
être réalisée, à cause de la consommation importante d’énergie, que dans des
pays ayant de l’énergie hydraulique comme la Norvège et la Suisse. La formation
de NO par cette voie est aussi appelée
combustion de l’air.
Des
mélanges d’azote et de NO2 appelés gaz nitrique sont produits
également par l’oxydation avec de l’acide nitrique concentré.
![]()
À part
le protoxyde d’azote et le monoxyde d’azote, les oxydes d’azote se dissolvent
dans l’eau en donnant des acides, il s’agit ainsi d’anhydrides d’acides (acide
nitreux et acide nitrique).
La
combustion de l’air à haute température au début du 20e siècle fut
la première étape de la production de l’acide nitrique. Le produit clé étant
NO, c’est Wilhelm Ostwald
(Professeur de chimie à Riga et à Leipzig, 1853-1932) qui développa le procédé
de la combustion de l’ammoniac en monoxyde d’azote à l’échelle industrielle. Le
français Frédéric Kuhlmann
avait proposé cette réaction en 1838 :
![]()
Mais
l’ammoniac ne fut disponible en grandes quantités qu’après la synthèse de Haber et Bosch (brevet 1910).
Les
oxydes d’azote étant des produits endothermiques, il n’est pas surprenant qu’à
des températures élevées et au contact avec des catalyseurs (pot catalytique)
ils se décomposent en donnant les deux éléments. A cause de cette propriété il est compréhensible que
les oxydes d’azote entretiennent la combustion.
Les oxydes d’azote dans l’atmosphère et dans la stratosphère
Dans
des moteurs à combustion pour la
locomotion, soit à l’essence soit au carburant diesel, les températures
atteintes sont environ de 2300° C. À ces températures il se forme également du
NO.
Le degré
de rendement du moteur est meilleur à des températures élevées. Mais dès que
les températures montent, la quantité de NO augmente exponentiellement. Dans
l’atmosphère le monoxyde d’azote réagit rapidement avec l’oxygène pour donner
du dioxyde d’azote. Ce dernier donne avec de l’eau les acides nitreux et
nitrique, responsables des pluies acides.
![]()
Un
procédé pour éliminer le monoxyde d’azote des installations de chauffage ou
lors de l’incinération des ordures est basé sur l’addition d’ammoniac qui
réagit en présence d’un catalyseur avec le NO pour donner de l’azote et de
l’eau par médiamutation (type de réaction inverse de
la dismutation).
![]()
Le
protoxyde d’azote a été une des premières substances anesthésiantes (1844). L’origine
du nom « gaz hilarant » n’est pas claire. On utilise le gaz hilarant
sous le code européen E 942
par exemple comme gaz propulseur
pour la crème Chantilly.
La
formation du protoxyde d’azote n’est pas exclusivement anthropogène. S’il y a
un manque d’oxygène dans le sol, de
l’engrais azoteux peut être transformé en protoxyde d’azote. D’autre part,
quelques petits organismes comme des larves d’insectes qui vivent dans l’eau et
qui mangent des détritus, en produisent ; De plus l’eau est souvent polluée par
des nitrates introduits par des eaux
usées et des engrais.
Au cours
de l’irradiation du protoxyde d’azote par la lumière UV, ce dernier est dégradé
en NO qui décompose à son tour l’ozone. On désigne par O* de l’oxygène atomique (un radical)
![]()
![]()
![]()
![]()
![]()
Le protoxyde d’azote est un gaz à effet de serre et on lui attribue un
potentiel de réchauffement global de 298 équivalents de CO2. Sa
durée de vie dans l’atmosphère est de 114 ans.
Du point
de vue médical le monoxyde d’azote est reconnu comme gaz toxique. Cependant, la
trinitrine (trinitroglycérol) dont la conversion métabolique en monoxyde
d'azote NO provoque une vasodilatation des artères notamment cardiaques est
utilisée pour traiter l'angine de poitrine ; il en est de même pour le
pentacyanonitrosylferrate de sodium. Le monoxyde d'azote est également utilisé
à très faible concentration dans un mélange air/oxygène, inhalé, pour traiter
l'hypertension artérielle pulmonaire néonatale.
En 1998 le prix Nobel de médecine a été attribué à
Fuchgott, Ignarro et Murad pour avoir
prouvé le rôle de médiateur du monoxyde d’azote.
Traduit de l’allemand par Pauline Werner