EXERCICE 9
(Enantiomérie)
Corrigé
Enoncé :
On procède à l'identification d'un composé
organique, A, sur lequel on possède les renseignements suivants :
- il ne contient que du carbone, de
l'hydrogène et de l'oxygène;
- son spectre infra-rouge
indique la présence de groupements hydroxyle et carbonyle;
- son spectre de masse permet de
déduire une valeur de sa masse molaire égale à 90,08 g.mol-1
- une micro-analyse élémentaire a
conduit aux résultats suivants :
. masse de A soumise à la combustion : 0,29276 g
. masse de dioxyde de carbone obtenue : 0,42910 g
. masse d'eau obtenue : 0,17566 g
l'oxygène est calculé par différence.
- une solution de 10,50 g de A dans 100
cm3 d'éthanol présente un pouvoir
rotatoire de : + 3,5°.
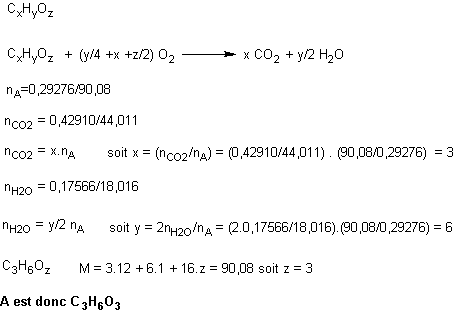
1) Quelle est la formule brute de A?
On donne les masses molaires
atomiques en g.mol-1 : M(H): 1,008 M(C): 12,011
M(O): 16,000
2) Enoncer la loi de BIOT.
3) Ecrire la formule développée plane de
A. Justifier son activité optique.
4) Le Handbook
indique que pour l'énantiomère dextrogyre, à cette concentration, la valeur du
pouvoir rotatoire est : 3,82°. Quelle hypothèse peut-on émettre pour expliquer
cette différence, un dosage indiquant que A est
chimiquement pur?
Corrigé :
1) Donnons à A
la formule moléculaire générale :
2)
L’activité optique d’une substance est caractérisée par son pouvoir rotatoire spécifique
[α]θ λ et
l’angle de rotation du plan de polarisation régi par la loi de Biot : α =
[α]θ λ .l.c
Avec :
L :
longueur de substance traversée en dm ;
c : concentration de la solution en g.cm-3 ;
α : angle de rotation exprimé en degrés ;
[α]θ λ : pouvoir
rotatoire spécifique en °.dm-1.g-1.cm3.
Θ :
est la température ;
λ : est la longueur d’onde de la lumière utilisée
(souvent la raie D du sodium).
3)
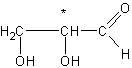
Son activité optique est due à la présence d’un
carbone asymétrique (celui marqué d’un astérisque).
4) Le composé A étant chimiquement pur, on ne peut
expliquer la différence que par la présence dans l’échantillon analysé des deux
isomères : le dextrogyre qui s’il était seul devrait donner un angle de
3,82° et le lévogyre qui par son signe négatif fait diminuer l’angle de
rotation due au mélange