EXERCICE 119
CORRIGE
Enoncé :
Formule de l'alanine :
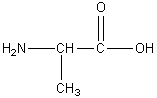
Lorsqu’on dissout de l’alanine
dans l’eau, elle est principalement sous forme d’ion dipolaire.
1) Ecrire les deux couples acido basiques relatifs
à la mise en solution de l’alanine dans l’eau.
2) Calculer le pH d’une solution aqueuse d’alanine à 0,10 mol.L-1. Sous quelle forme
trouve-t-on l’alanine en solution aqueuse ?
3) A 100mL de cette solution on ajoute sans variation de volume nHCl
= 1.10-2 mole d’acide chlorhydrique.
Calculer, le pH de la solution obtenue.
Données : alanine : pKa1 = 2,3 ; pKa2 = 9,9.
Pour simplifier l’écriture des équations de réactions on pourra noter l’amphion ou zwitterion : AH+
-.
Corrigé :
1) Les deux couples acide/base associés à l’alanine en solution aqueuse
peuvent s’écrire :
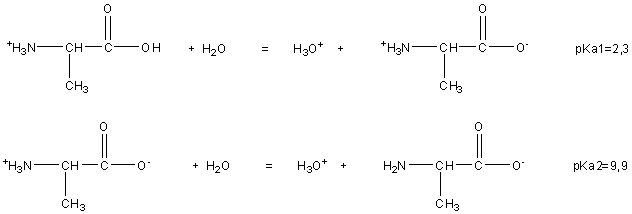
2) Le calcul simplifié du pH passe par la détermination de la réaction acido basique prépondérante RP :
Lorsqu’on dissout de l’alanine dans l’eau,
elle est principalement sous forme d’ion dipolaire noté AH+ -.
Cette espèce se comporte comme un amphotère, son pH est donné par la relation :
![]()
Soit pH = ½(2,3+9.9) = 6,1.
Vérifications :
- A ce pH c’est bien l’espèce AH+ - qui prédomine.
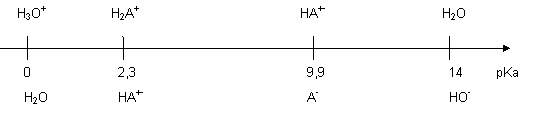
- En comparant les constantes d’équilibres (K = K2/K1)
des quatre réactions possibles on trouve pour les valeurs des constantes d’équilibres
: K : 10-14
; 10-9,9 ; 10-11,7 ; 10-7,6. c’est bien cette
dernière qui est la plus élevée et qui correspond à : 2 AH+ -
= HA+ + A-.
3) L’addition de 1.10-2
mol de HCl à 100mL de solution de AH+ -
sans variation de volume conserve la concentration de l’alanine (0,1 mol.L-1) et
permet de calculer la concentration des espèces H3O+ et Cl-.
Equation de réaction modélisant la transformation et considérée comme
réaction prépondérante RP :
AH+ - + H3O+
= H2A+
+ H2O
K = 1/Ka1 = 10 + 2,3
|
|
AH+ - |
H3O+ |
H2A+ |
H2O |
|
E.I. |
0,1 |
0,1 |
0 |
|
|
E.F. |
0,1-x |
0,1-x |
x |
|