EXERCICE 26
CORRIGE
Exercice (a)
Enoncé
Un composé organique A de formule moléculaire C9H10
réagit avecun halogène pour donner C9H10X2 . A réagit
sur l'eau pour donner un alcool, B, oxydable par le mélange sulfochromique,
en cétone, C, qui peut réagir avec le diiode en
milieu alcalin pour donner un sel de l' acide D.
L'acide D, peut être oxydé, et conduit à l'acide orthophtalique.
Donner le chemin de réactions, conduisant de A à D
après avoir, au brouillon, trouvé les différentes formules A,B,C,D.
Solution
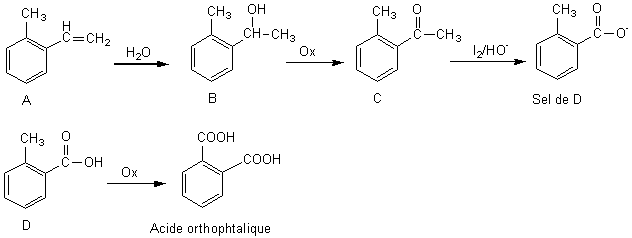
A : (2-méthylphényl)éthène ou o.méthylstyrène
B : 1-(2-méthylphényl)éthanol
C : Méthyl,2-méthylphénylcétone
Sel de D: ion 2-méthylbenzoate
D: acide 2-méthylbenzoïque
Exercice (b)
Enoncé:
On veut déterminer la formule d'un ester (A).
La saponification de 5,8 g de A par la potasse
nécessite 2,8g de potasse anhydre. La saponification donne un composé B et un
composé C. B contient 34,8 % de potassium. C oxydé par le dichromate de sodium
en milieu acide donne un composé D. D donne un précipité avec la 2,4-DNPH ; il
ne réduit pas la liqueur de Fehling, mais il donne un précipité jaune en
présence de diiode en milieu basique.
Donner la formule semi développée et le nom de A.
M(K) = 39,1 g.mol-1
Solution
La réaction de saponification s'écrit:
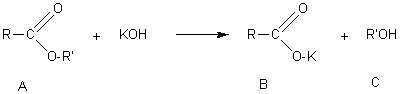
La réaction ayant lieu mole à mole on peut écrire:
nA=nKOH soit ![]() et donc
et donc ![]()
On trouve ![]()
Par ailleurs, la formule de B fait apparaître qu'une mole de B renferme une
mole de K, et l'énoncé indique que B contient 34,8% de K; on rassemble tout
ceci dans l'équation:
![]()
![]()
La conservation de la masse lors d'une transformation chimique nous conduit à
écrire pour la saponification:
![]() on en tire:
on en tire:
![]() soit numériquement:
soit numériquement:
![]() soit 60 g.mol-1
soit 60 g.mol-1
La masse de R'- s'en déduit: MR'=MC - 17 (masse de OH) = 43g.mol-1.
La formule générale d'un groupement alkyle étant CnH2n+1, sa
masse est 14n+1
On en déduit pour R': 14n+1 = 43 soit n = 3.
C est un alcool à 3 carbones.
C oxydé donne D qui est une cétone méthylée (en effet
D donne un précipité avec la 2,4-DNPH c'est un composé carbonylé; il ne réduit pas la liqueur
de Fehling, c'est une cétone; ll donne
un précipité jaune en présence de diiode en milieu
basique, c'est une cétone méthylée). D est donc
la propanone.
C est un alcool secondaire c'est le propan-2-ol. R' est le radical
isopropyle.
La masse de R se déduit de la masse de A :
MR=MA-MR'-MC-2MO=
116,2 - 43 - 12 - 2x16 = 29,2 g.mol-1.
Comme pour R' on écrit:
14n+1 = 29 soit n = 2. R est le radical éthyle CH3-CH2-
La formule semi-développée de A est:
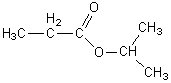
C'est le propanoate d'isopropyle
ou le propanoate de 1-méthyléthyle.