EXERCICE 27
Corrigé
Exercice1:
Enoncé
1) On fait brûler 1cm3 de
benzène liquide dans du dioxygène.
Calculer le volume de CO2 (dans les CNTP) et la
masse d'eau formée, la combustion étant complète.
2) A quel volume de vapeur, en cm3,
correspond ce cm3 de
benzène liquide, à 25°C et la pression atmosphérique normale, sachant que 1L
d'air a dans ces conditions une masse de 1,29g.
On donne:
MC= 12g.mol-1
MO= 16g.mol-1
MH= 1g.mol-1
Densité du benzène liquide: dl= 0,884
Volume molaire dans les CNTP: 22,4L.mol-1
Corrigé
1)
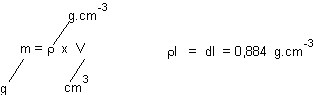
La masse de benzène
liquide correspondant à 1 cm3 de benzène liquide est donc de 0,884g.
Ce qui correspond à
une quantité de matière en mole, de :
![]()
L’équation de la
réaction de combustion est :
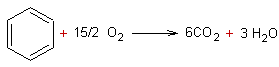
La quantité de
matière de CO2 formée est nCO2 = 6 x 0,01133 = 0,068 mol
Le volume de CO2
formé est VCO2 = 0,068 x 22,4 = 1,5232
L
La quantité de
matière de H2O formée est nH2O = 3 x 0,01133 = 0,034 mol
La masse de H2O
formé est mH2O = 0,034 x 18 = 0,612
g
2) Tous les gaz
occupant le même volume dans les mêmes conditions de température et de pression
(22400 cm3.mol-1 dans les CNTP) le volume de benzène
gazeux correspondant à 1 cm3 de benzène liquide est :
0,01133 x 22400 = 253,86 cm3.
Exercice 2
Enoncé
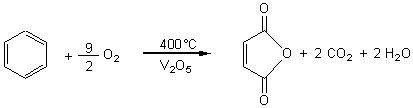
Ecrire l'équation de réaction du benzène
avec le dioxygène en présence de V2O5 (oxyde de
vanadium). Nom du produit principal formé?
Corrigé