EXERCICE 32
Détermination d'une structure
Corrigé
Enoncé :
Un ester (X), fabriqué à partir d'un a-monoaminoacide (Y) et d'un monoalcool (Z)
saturés, a pour masse molaire M=187g.mol-1.
Données:
|
Elément |
H |
C |
N |
O |
|
Numéro atomique |
1 |
6 |
7 |
8 |
|
Masse molaire (g.mol-1) |
1,0 |
12,0 |
14,0 |
16,0 |
1) Détermination de la formule de l'acide a-aminé Y.
1-1)
Trouver sa masse molaire sachant qu'il renferme 12,0% d'azote.
1-2)
Indiquer la formule moléculaire de Y.
1-3) Donner
les formules développées possibles pour Y.
1-4) Cet
acide a-aminé est
linéaire et optiquement actif.
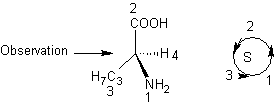
a) Donner son nom, sa formule et représenter un de ses énantiomères en
représentation de Cram.
b) Indiquer en justifiant la méthode employée, la configuration absolue de
l'énantiomère représenté.
2) Détermination de la formule de l'alcool Z.
2-1) Donner
la formule moléculaire de Z, après avoir déterminé sa masse molaire.
2-2) On
réalise la suite de réactions ci-dessous:
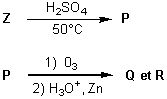
Q de masse
molaire M = 44g.mol-1, réduit la liqueur
de Fehling.
R, de masse molaire M = 58 g.mol-1, donne un précipité d'iodoforme (triiodométhane) avec le diiode en
milieu basique.
Identifier les composés P,Q,R
(noms et formules). Justifier brièvement.
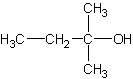
Sachant que Z est un alcool tertiaire,
identifier Z (nom et formule).
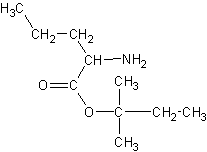
2-3) Donner
la formule de l'ester X; écrire l'équation bilan de sa formation.
Corrigé :
1) La
formule de Y est du type :
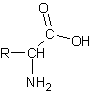
1-1) R a
pour formule générale CnH2n+1 et Y Cn+2H2n+5NO2
La masse
molaire de Y est donc 14n + 75
La masse
d’azote dans une mole est 12x(14n + 75)/100 = 14
On en déduit
n = 3
D’où M(Y) =
117 g.mol-1
1-2) La formule moléculaire de Y : C5H11NO2
1-3)
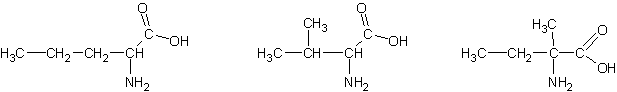
1-4) a et b) cet acide aminé étant linéaire il
s’agit de
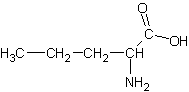 Acide 2-aminopentanoïque
Acide 2-aminopentanoïque
2) 2-1) La formule générale d’un ester est
RCOOR’ provenant de l’acide RCOOH et de l’alcool R’OH. La masse molaire de
l’ester étant 187 g.mol-1 et celle de
l’acide 117 g.mol-1 on en déduit assez
aisément que la masse molaire de R’ est 187 – (117-1) = 71 g.mol-1.
La masse molaire de Z (R’OH) est M(Z) = 71 + 1 + 16 = 88 g.mol-1.
M(Z) = M(CnH2n+2O) = 14n +2 + 16 = 88 soit n = 5.
La formule moléculaire de Z est C5H12O.
2-2)
La première réaction est une déshydratation on passe d’un alcool à un
alcène ; P est un alcène. La deuxième réaction est une ozonisation suivie
d’une hydrolyse en milieu réducteur. On aboutit à deux composés
carbonylés ; Q et R sont deux composés carbonylés.
Q
réduit la liqueur de Fehling…C’est un aldéhyde.
R
est une cétone méthylée (réaction haloforme).
La formule moléculaire de P : C5H10 C’est un pentène.
La
formule moléculaire de Q : C2H4O C’est l’éthanal (sa
masse molaire étant de 44 g.mol-1)
La
formule moléculaire de R : C3H6O
C’est la propanone (sa masse molaire étant de 58 g.mol-1)
La formule
de Z :
2-3) L’ester X est :