EXERCICE 34
Corrigé
Enoncé
Préparation
du 2-méthylphénol (orthocrésol)
Les crésols traditionnellement isolés dans les produits de distillation des
goudrons de houille et de pétrole sont des réactifs très demandés en chimie
fine, d'où l'obligation de mettre au point des procédés de synthèse.
L'orthocrésol peut être préparé par méthylation du phénol.
1) Première étape :
synthèse du phénol par le procédé Hock.
Réaction 1: on fait réagir du benzène et du propène en
présence d'un catalyseur approprié. Cette réaction donne l'isopropylbenzène
(cumène).
Réaction 2: le cumène est oxydé
en hydroperoxyde de cuményle
par le dioxygène de l'air.
Réaction 3: l'hydroperoxyde de cuményle est décomposé en phénol et en propanone.
1-1) Ecrire les équations des réactions 1,2 et 3.
1-2) Indiquer de quel type est la réaction 1.
1-3) Donner un catalyseur possible pour cette réaction.
1-4) Indiquer la formule de l'électrophile intervenant lors de cette
réaction.
2) Deuxième étape : méthylation du phénol.
Au laboratoire, le phénol est méthylé par le bromométhane en présence d'un acide de Lewis, le trifluorure de bore,BF3.On
obtient deux composés organiques isomères de formule brute C7H8O.
2-1) Donner la formule semi-développée et le nom de ces deux isomères.
2-2) Ecrire l'équation de la réaction conduisant du phénol à l'un de ces
deux isomères.
2-3) Justifier l'obtention de ces deux isomères.
Corrigé
1) Première étape: synthèse
du phénol par le procédé Hock:
1-1) Réaction 1:
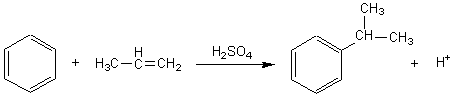
Réaction 2:
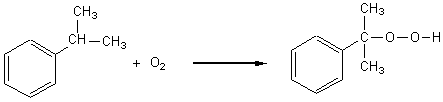
Réaction 3:
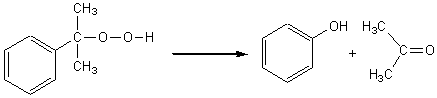
1-2) La réaction 1 est une substitution électrophile. En
effet, la première étape du mécanisme est l'addition d'un ion H+ sur
la double liaison de l'alcène et formation du carbocation:
![]()
1-3) Un catalyseur possible pour cette réaction est un acide
protonique, par exemple H2SO4.
1-4) L'électrophile est donc le carbocation: ![]()
2) Deuxième étape: méthylation du phénol.
2-1) 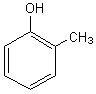 Ortho-crésol
ou 2-méthylphénol
et
Ortho-crésol
ou 2-méthylphénol
et 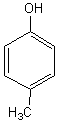 Para-crésol
ou 4-méthylphénol.
Para-crésol
ou 4-méthylphénol.
2-2) 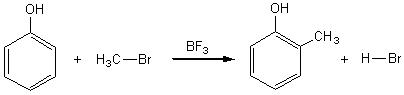
2-3) -OH appartient au premier groupe des règles de Holleman ; en repoussant les électrons de liaison vers le
noyau, il augmente la densité électronique au niveau des carbones 2 et 4. La
conséquence est une activation de ce noyau et une plus grande réactivité
vis-à-vis d'une deuxième substitution électrophile, avec orientation en o. et
p.