EXERCICE
38
Corrigé
Enoncé :
Question 1:
Ecrire l'équation de réaction du benzène avec le dichlore
en présence de AlCl3 . Nom du produit A
formé ?
Question 2:
On fait réagir 100cm3 de benzène (d=0,884) et 1L de dichlore (gaz dans les CNTP) en présence de AlCl3 .
a) La réaction a-t-elle lieu dans les proportions stoechiométriques? Si ce n'est pas le cas, quel est le
réactif en excès?
b) Calculer la masse théorique du produit préparé.
c) En réalité on obtient 2,5g du dérivé monochloré.
Calculer le rendement de la préparation.
On donne:
Volume molaire dans les CNTP: 22,4L.mol-1 MC=
12g.mol-1 MH=
1g.mol-1 MCl= 35,5g.mol-1
Corrigé :
Question
1 :
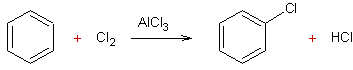
A
est le monochlorobenzène.
Question
2 :
a) nC6H6
= Vxρ/MC6H6 =
100x0,884/(6x12+6) = 1,13333 mole
nCl2 = v/Vmolaire = 1/22,4 = 0,04464 mole
La
reaction entre le benzène et le dichlore
ayant lieu mole à mole dans les conditions stoechiométriques,
et les quantités de départ n'étant pas égales il existe un réactif limitant qui
est le réactif présent au départ en plus petite quantité, c'est-à-dire le dichlore. Le réactif en excès est donc le benzène.
b) Le coefficient stoechiométrique
du chlorobenzène étant égal à celui du dichlore
(réactif limitant), il se formera en théorie autant de moles de chlorobenzène
qu'il y avait de moles de dichlore au départ soit :
0,04464 mol. La masse théorique de A est donc :
mth = nCl2 x
MA = 0,04464 x (6x12 + 5 + 35,5) = 5,0 g
c) Le rendement de la préparation est : R = (mobtenue//mthéorique)x100 = (2,5/5,0)x100 = 50%