EXERCICE 131
CORRIGE
ENONCE :
Une des synthèses de la dipipanone, molécule ayant
des propriétés similaires à celles de la méthadone (produit utilisé dans la
désintoxication des toxicomanes), est la suivante :
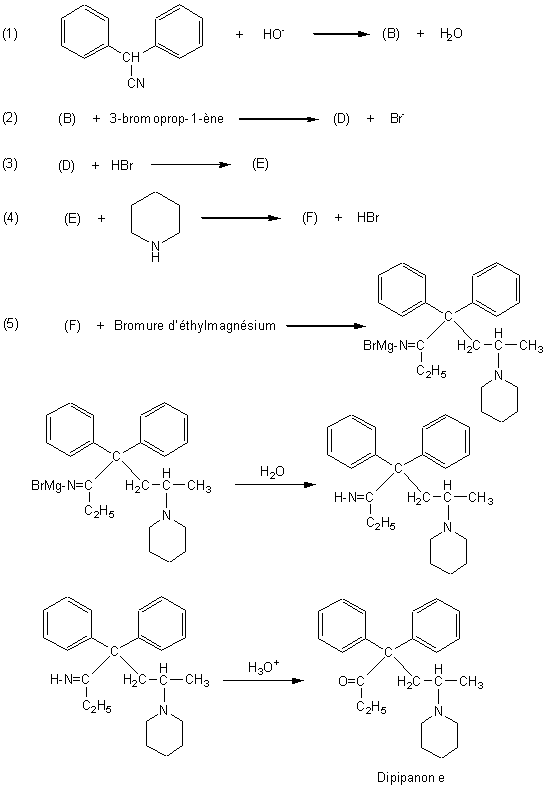
1) Le point de départ de la synthèse est la formation d'un carbanion (B) à partir de la molécule (A) :
1-1) Donner le nom de la molécule (A) ; quel est le nom
du groupe fonctionnel qu'elle porte ?
1-2) Pour obtenir la molécule (A) on peut faire réagir
par réaction de Friedel et Crafts (alkylation) le 2-bromo-2-phényléthanenitrile sur
le benzène ; donner l'équation correspondant à cette réaction en précisant le
catalyseur utilisé.
1-3) Dans la molécule (A), l'hydrogène en a du groupe fonctionnel est
très acide, le carbanion (B) qui résulte de son
départ par l'action d'une base forte (réaction (1)) est en effet stabilisé par
la présence des deux noyaux aromatiques et par la présence du groupe
fonctionnel. Donner la formule du carbanion (B).
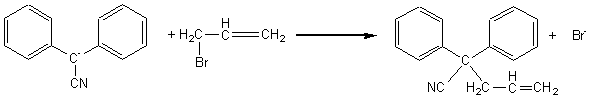
2) Lors de la réaction de (B) sur le 3-bromoprop-1-ène (réaction (2)), on obtient par substitution nucléophile,
le 2,2-diphénylpent-4-ènenitrile
: composé (D). Ecrire à l'aide de formules l'équation de la réaction (2).
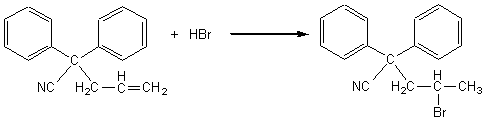
3) L'action de HBr sur (D) est une addition régiosélective (qui obéit à la règle de Markovnikov)
sur la double liaison carbone-carbone.
3-1) Enoncer la règle de Markovnikov.
3-2) Ecrire l'équation de la réaction (3) en remplaçant
les lettres (D) et (E) par la formule des molécules qu'elles représentent.
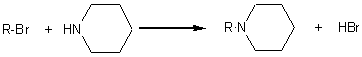
4) La réaction d'Hofmann entre (E) et une amine, la pipéridine ou azacyclohexane (réaction (4)), permet la formation d'un
composé (F).
4-1) Quelle est la classe de la pipéridine ?
4-2) Ecrire l'équation de la réaction entre le composé
(E) que l'on écrira R-Br et la pipéridine.
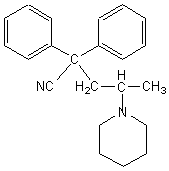
4-3) Donner la formule du composé (F).
4-4) Cette réaction est-elle une addition électrophile,
une addition nucléophile, une substitution électrophile, une substitution
nucléophile, ou une élimination ?
5) La dernière étape conduit, par action d'un organomagnésien suivi de deux
hydrolyses (réactions (5)) à la dipipanone.
5-1) L'organomagnésien utilisé est le bromure d'éthylmagnésium ; donner sa formule.
5-2) Ecrire l'équation de la réaction permettant de
préparer ce composé en précisant les réactifs utilisés, le milieu nécessaire et
les conditions opératoires.
6) Stéréoisomérie :
6-1) La molécule de dipipanone
est-elle optiquement active ? justifier.
6-2) Représenter en représentation de Cram
le stéréoisomère (R) en précisant les règles
utilisées.
6-3) Les stéréoisomères (R) et
(S) de la dipipanone sont-ils des énantiomères ?
Justifier.
CORRIGE :
1)
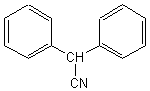
1-1) Le nom de la molécule A est : 2,2-diphényléthanenitrile
; elle porte un groupe nitrile -CN .
1-2)
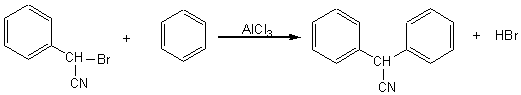
Le catalyseur utilisé est le trichlorure d'aluminium, AlCl3.
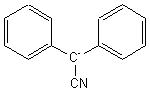
1-3)Le carbanion
(B) est :
2) L'équation de la réaction (2) est :
3)
3-1) Règle de MARKOVNIKOV (régiosélectivité)
: lors de l'addition d' un halogénure d'hydrogène, sur une double liaison
carbone-carbone, l'hydrogène se fixe sur le carbone le plus hydrogéné (le moins
substitué).
3-2) L'équation de la réaction (3) est :
4)
4-1) La pipéridine est une amine secondaire puisque l'azote
est lié à deux atomes de carbone (et par conséquent n'est lié qu'à un atome
d'hydrogène).
4-2)
4-3) Le composé (F) est :
4-4) Cette réaction est une substitution nucléophile
initiée par le doublet libre de l'azote.
5)
5-1) Le bromure d'éthylmagnésium
a pour formule : C2H5MgBr.
5-2) Il faut travailler en milieu anhydre pour fabriquer un organo-magnésien. L'équation qui modélise la formation du
bromure d'éthylmagnésium est :
![]()
6) Stéréoisomérie :
6-1) La molécule de dipipanone est
optiquement active, elle possède un carbone asymétrique marqué par un
astérisque dans la formule ci-après :
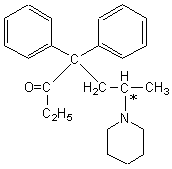
6-2) Le stéréoisomère (R) est :
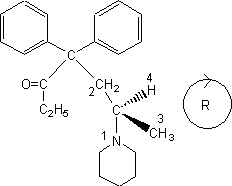
Règles de Cahn-Ingold-Prelog :
On numérote les atomes de premier rang fixés sur le carbone asymétrique en
donnant le plus petit numéro à l'atome de plus grand numéro atomique (Z) : ici
le numéro 1 est donné à l'atome d'azote (N = 7) ; le numéro 4 est donné à
l'atome d'hydrogène (Z = 1) ; Pour départager les deux carbones on s'adresse
aux atomes de second rang ; l'un est lié à un carbone et deux hydrogènes tandis
que l'autre est lié à trois hydrogènes. Le premier aura donc le numéro 2 et le
second le numéro 3. Pour déterminer la configuration absolue, on place l'oeil dans l'axe de la liaison C*-4 de C* vers 4 et suivant
le sens de rotation pour aller de 1 vers 2 vers 3 on conclut. Ici on doit
tourner dans le sens des aiguilles d'une montre. Le stéréoisomère
représenté est R.
6-3) Les deux stéréoisomères R et
S sont des énantiomères car la molécule ne possède qu'un carbone asymétrique.
Si l'un des stéréoisomères est dextrogyre d'un angle a l'autre sera lévogyre d'un
angle -a.