EXERCICE 120
Corrigé
ENONCE
Sur une bouteille d'huile de colza du commerce, on lit la composition de
l'huile pour 100g :
8g de triester palmitique (C51H98O6),
61g de triester oléique (C57H104O6), 1g de
triester érucique (C69H128O6), 21g de triester
linoléique (C57H98O6), 9g de triester linolénique (C57H92O6).
1) Donner la formule des acides gras dont dérivent chacun de ces triesters
sous la forme (a:b) où a indique le nombre d'atomes
de carbone et b le nombre de doubles liaisons.
2) On souhaite déterminer l'indice d'iode de cette huile de deux façons ;
2-1) Rappeler la définition de l'indice d'iode d'un corps
gras.
2-2) Méthode analytique :
En utilisant la composition de cette huile, les formules des esters la
composant, les doubles liaisons des acides gras correspondants ainsi que la
masse molaire de l'iode, déterminer l'indice d'iode que l'on appellera
théorique (Ith) de cette huile de colza.
Données : M(C)= 12 g.mol-1
M(H)= 1 g.mol-1 M(O)= 16
g.mol-1 M(I)= 127 g.mol-1
2-3) Méthode expérimentale :
- Dans
une première fiole conique de 250 mL à col rodé notée
A on pèse précisément environ 250 mg d'huile de colza ; on ajoute 15 mL de chloroforme puis 25,0 mL de
réactif de Wijs. On bouche et on agite.
- Dans
une seconde fiole conique de 250 mL à col rodé notée
B on introduit 15 mL de chloroforme puis 25,0 mL de réactif de Wijs. On bouche
et on agite.
- On
place les deux fioles à l'obscurité pendant une heure.
- On
ajoute ensuite 1g de KI et 50 mL d'eau dans chacune
des fioles et on agite pendant cinq minutes.
- On dose
le contenu de chacune des deux fioles avec une solution de thiosulfate de
sodium de concentration Cthio = 0,20 mol.L-1 .
Résultats de l'expérience :
masse d'huile pesée : mhuile
= 254 mg
Volume de thiosulfate versé :
fiole A :
VéqA= 5,20 mL
fiole B :
VéqB= 16,40 mL
2-3-1)
Ecrire l'équation chimique de la réaction du réactif de Wijs
(ICl) sur une double liaison carbone-carbone.
2-3-2)
Ecrire l'équation de réaction du réactif de Wijs en
excès sur les ions iodures en solutions (on écrira d'abord les demi-équations rédox).
2-3-3)
Ecrire l'équation de réaction du thiosulfate de sodium sur le diiode formé lors de la réaction du 2-3-2).
2-3-4)
Déduire du 2-3-3) la relation qui existe entre n(S2O32-)
et n(I2) lors d'un dosage du diiode par le
thiosulfate de sodium.
2-3-5)
Utiliser la relation précédente pour exprimer la quantité de diiode nA lors
du dosage de la fiole A, puis celle nB
lors du dosage de la fiole B en fonction de Cthio
et des Véq de thiosulfate.
2-3-6) En
déduire l'expression de la quantité de réactif de Wijs
ayant réagi avec l'échantillon d'huile de colza. Cette quantité est égale à
celle de I2 qui aurait réagi avec l'échantillon si l'on avait
utilisé I2 au lieu de ICl, on l'appellera nI2(huile).
2-3-7) En
déduire l'expression de l'indice d'iode expérimental noté Iexp
de cette huile de colza en fonction de Cthio,
VéqA, VéqB,
mhuile, M(I).
2-3-8)
Calculer l'indice d'iode expérimental et le comparer à celui théorique calculé
à la question 2-2).
CORRIGE
1) Acide palmitique :C16H32O2 (16:0) ; acide oléique C18H34O2 (18:1) ; acide érucique C22H42O2 (22:1) ; acide linoléique C18H32O2 (18:2) ; acide linolénique C18H30O2 (18:3) .
2) 2-1) L'indice d'iode d'un corps gras est la masse de diiode exprimée en gramme fixée par 100g de ce corps gras
en solution dans le chloroforme.
2-2) Calculons pour chaque ester insaturé
la quantité de matière (n) présente pour 100g d'huile de colza, puis le nombre
de moles de doubles liaisons (nl).
- Triester oléique du glycérol : C57H104O6
M = 884 g.mol-1
n(oléique) = 61/884 = 0,06900 n(l)oléique
= 3x0,06900 = 0,2070
- Triester érucique du glycérol : C69H128O6
M = 1052 g.mol-1 n(érucique)
= 1/1052 = 0,000951 n(l)érucique = 3x0,000951 =
0,0029
- Triester linoléique du glycérol : C57H98O6
M = 878 g.mol-1
n(linoléique) = 21/878 = 0,02392 n(l)oléique
= 3x2x0,02392 = 0,1435
- Triester linolénique du glycérol : C57H92O6
M = 872 g.mol-1
n(linolénique) = 9/872 =
0,01032 n(l)oléique = 3x3x0,01032 = 0,0929
Au total le nombre de moles de doubles liaisons présentes dans 100g d'huile de
colza est:
N(l) = 0,2070 + 0,0029 + 0,1435 + 0,0929 = 0,4463
L'indice d'iode théorique vaut donc :
Ith = 0,4463x127x2 = 113
2-3)
2-3-1)
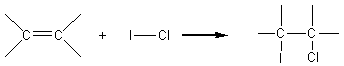
2-3-2)
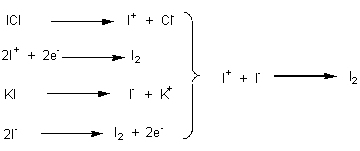
2-3-3)

2-3-4)
![]()
2-3-5)
![]()
![]()
2-3-6)
![]()
2-3-7)
![]()
2-3-8)
![]()
I exp= 112
La comparaison avec l'indice théorique (113) nous
montre une bonne concordance (1% environ).