EXERCICE 67
Corrigé
Enoncé
Synthèse de la 4-nitroacétophénone
La synthèse de la 4-nitroacétophénone constitue le
début de la synthèse d'un antibiotique puissant: le chloramphénicol.
Malheureusement, la synthèse de la 4-nitroacétophénone
est beaucoup moins directe que celle de son isomère, la 3-nitroacétophénone.
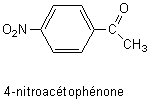
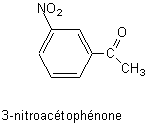
1) Préciser le type d'isomérie existant entre ces deux molécules.
2) On peut préparer la 3-nitroacétophénone en deux
étapes à partir du benzène et de tout produit chimique nécessaire.
2-1) Proposer une synthèse en deux étapes permettant de
passer du benzène à la 3-nitroacétophénone; préciser
les conditions opératoires.
2-2) L'ordre des étapes proposées a-t-il une importance?
Justifier.
2-3) Ces deux étapes mettent en jeu un même type de
réaction: préciser son nom.
2-4) Donner la formule de l'espèce électrophile mise en
jeu dans la première étape proposée (réaction avec le benzène).
3) La synthèse de la 4-nitroacétophénone est
proposée ci-dessous. Dans un premier temps, on prépare le chlorure de 4-nitrobenzoyle, selon la suite de réactions suivante:
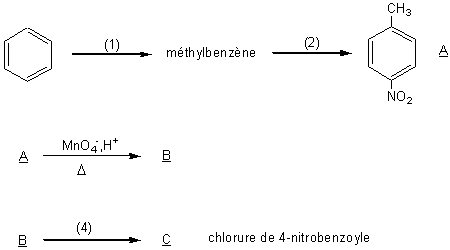
3-1) Ecrire l'équation de la réaction(1), en précisant le
nom du catalyseur éventuellement nécessaire.
3-2) Donner la formule semi-développée et le nom du
composé B.
3-3) Ecrire l'équation de la réaction conduisant de A
à B, sachant que les ions MnO4-sont réduits en ions Mn2+(les demi-équations d'oxydo-réduction sont demandées).
3-4) Donner la formule d'un réactif permettant de
réaliser la transformation de B en C.
4) La seconde partie de la synthèse de la 4-nitroacétophénone
est schématisée ci-dessous, à partir du chlorure de 4-nitrobenzoyle
C :
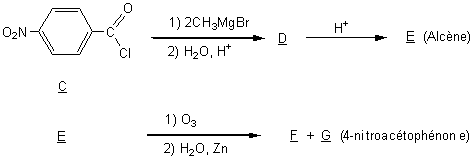
4-1) Indiquer le type de
solvant à utiliser lors de la préparation de l'organomagnésien CH3MgBr, ainsi que
les conditions opératoires.
4-2) Donner la formule
semi-développée de D.
4-3) Passage de D à E.
4-3-1)
Expliquer pourquoi le passage de D à E se fait pratiquement sans
chauffer.
4-3-2)
Donner la formule semi-développée de E.
4-4) Ozonolyse.
4-4-1)
Donner la formule semi-développée de F.
4-4-2)
Préciser le rôle du zinc lors de l'hydrolyse.
Corrigé
1) Isomérie de position.
2) 2-1)
2-2) Les
deux groupements à introduire sont méta-orienteurs; l'ordre des étapes
n'a donc pas d'importance.
2-3)
Substitution électrophile.
2-4) Ici c'est
CH3CO+ (si on commence par la nitration, c'est NO2+ ).
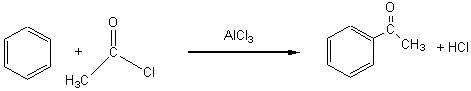
3) 3-1)  Catalyseur AlCl3
.
Catalyseur AlCl3
.
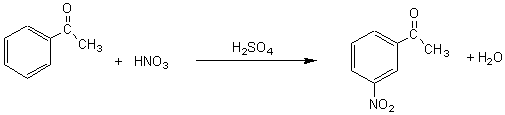
3-2)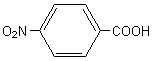 (noté
R-COOH dans la suite). Son nom : acide 4-nitrobenzoïque.
(noté
R-COOH dans la suite). Son nom : acide 4-nitrobenzoïque.
3-3) MnO4- + 8H+ + 5e-
= Mn2+ + 4 H2O
R-CH3 + 2 H2O = R-COOH + 6H+
+ 6e-
6 MnO4- + 5R-CH3 + 18H+ = 6
Mn2+ + 5 R-COOH+ 14 H2O
3-4) SOCl2 ou PCl5
4) 4-1) Ether anhydre (solvant
anhydre et non protogène, en fait).
4-2) 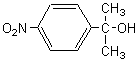
4-3) 4-3-1) L'alcool est tertiaire; il se déshydrate très
facilement en alcène car cet alcène est très substitué (et conjugué avec le
cycle aromatique), donc stable.
4-3-2) 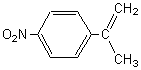
4-4) 4-4-1)![]()
4-4-2)Cela permet d'éviter l'oxydation de ![]() formé.
formé.