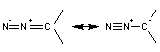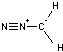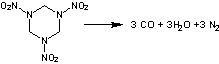DES MOLECULES ORGANIQUES INSTABLES
Gérard GOMEZ
Plan de l'étude
1)
Les indices de stabilité d'une molécule
2)
Caractère explosif d'une réaction
3)
Quelques molécules très instables
Annexe 1 Enthalpie de décomposition et chaleur de combustion.
Annexe 2 Formation d'hydroperoxyde de diéthyléther dans un flacon
d'éther.
Annexe 3 Gomme styrène-butadiène (SBR)
Annexe 4 Adipate de bis-2-éthylhexyle - Sébaçate de bis-2-éthylhexyle
Annexe 5 Phtalate de di-n-octyle - Citrate de tri-n-butyle
Annexe 6
N-phényl-2-naphtylamine
Annexe 7 Sudan IV et Sudan I
Annexe 8 Polyisobutylène
Annexe 9 DMNB (2,3-DiMéthyl-2,3-diNitroButane)
Annexe 10 EGDN (DiNitrate d'Ethylène Glycol)
1) Les indices de stabilité d'une molécule
Il
existe plusieurs indices qui peuvent nous renseigner sur la stabilité ou
l'instabilité d'une molécule :
- Le caractère endothermique de sa réaction
de formation.
Plus la
réaction de formation est endothermique et plus celle de décomposition va être
exothermique (voir annexe 1) ; c'est un facteur
d'instabilité auquel n'est pas étrangère la présence de liaisons multiples dans
la molécule.
Exemple :
- L'enthalpie de formation de
l'éthyne (acétylène) est égale à +227,4 kJ.mol-1 à 25°C et 1 bar ;
il s'agit donc d'une réaction endothermique. Cette valeur est importante et
liée à la présence d'une triple liaison entre les deux atomes de carbone de la
molécule ; l'acétylène est un composé très réactif.
- En comparaison l'éthène (éthylène)
qui a une double liaison entre les deux atomes de carbone est plus stable ; son
enthalpie de formation est + 52,4 kJ.mol-1 à 25°C et 1 bar, il
s'agit encore d'une réaction endothermique.
- Pour l'éthane la valeur est -84,0
kJ.mol-1 à 25°C et 1 bar ; c'est une réaction exothermique. L'éthane
est une molécule stable.
- Les liaisons de faible énergie par exemple O-O
ou N-N
On peut
comparer les énergies de liaison O-O ou N-N avec celle de C-C qui est la
référence dans l'échelle des stabilités :
|
C-C |
348
kJ.mol-1 |
|
O-O |
146
kJ.mol-1 |
|
N-N |
163
kJ.mol-1 |
Ainsi l'hydroperoxyde de diéthyléther
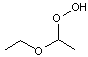
qui se
forme dans l'éther ordinaire (diéthyl éther ou éthoxyéthane), par
photooxygénation (radicaux formés à partir du dioxygène de l'air par excitation
par les UV) (voir annexe 2), rend dangereuse la
conservation de cette substance dans des flacons ; en effet il peut se produire
à partir de l'éther des réactions en chaîne conduisant à de grandes quantités
d'hydroperoxyde, produit très instable pouvant donner lieu à une explosion.
On peut
citer quelques autres groupements d'atomes renfermant des liaisons de faible
énergie et rendant les molécules qui les contiennent instables :
|
Groupe nitro -NO2
|
Exemple : le 2-nitropropane
|
|
Groupe
diazo
|
Exemple : Le diazométhane
Ce
composé, très réactif, est utilisé dans les réactions de Arndt-Eistert qui
permet de passer d'un acide carboxylique à son homologue supérieur. |
Remarques :
La nature
du groupe présent ne détermine pas à elle seule la
stabilité de la molécule
-
la longueur de la chaîne carbonée de la molécule intervient ; ainsi le
nitrobutane est plus stable que le nitrométhane.
|
|
Nitrométhane |
|
|
Nitrobutane |
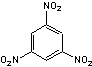
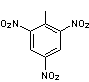
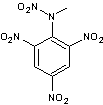
- Le nombre de groupes présent dans
la molécule intervient aussi ; ainsi le 1,3,5-trinitrobenzène est moins stable
que le mononitrobenzène.
|
|
Mononitrobenzène |
|
|
Trinitrobenzène |
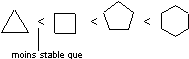
- La tension d'angles des cycles
Le
cyclopropane est moins stable (donc plus réactif) que les cycloalcanes ayant
davantage de carbones dans le cycle.
|
|
- Existence de groupes très oxydants dans
une molécule organique
La
présence dans une molécule organique de groupes fortement oxydants est un
facteur d'instabilité (le carbone est un réducteur notable) et peut entraîner
des réactions au caractère explosif.
C'est
le cas par exemple du trinitrate de glycérol (ou nitroglycérine) qui est une
molécule très instable.
![]()
2) Caractère explosif
d'une réaction
L'instabilité
d'une molécule liée à un ou plusieurs caractères cités précédemment peut
parfois, pour certaines d'entre elles, se traduire par une explosion lorsque
cette molécule est placée dans des conditions particulières de température
et/ou de pression, ou lors de frottements ou de chocs.
Une
explosion due à une substance chimique se produit lorsqu'une réaction très
exothermique a lieu, libérant instantanément une grande quantité de chaleur
ainsi que, souvent, une grande quantité de gaz ; ceux-ci soumis à une
température très élevée se dilatent et se déplacent à grande vitesse.
- Cette tendance à l'explosion a été
évoquée pour l'hydroperoxyde de diéthyléther qui se forme dans des flacons d'éther
; c'est le cas aussi pour la plupart des peroxydes.
- C'est également ce qui peut se
produire avec le trinitrate de glycérol (ou nitroglycérine), liquide à la
température ordinaire, très instable, qui peut par choc ou élévation de
température donner une réaction explosive.
Une
explosion se caractérise par les effets suivants :
- Une onde de pression statique,
" onde de choc" qui se propage d'abord à l'intérieur de la masse
explosive.
- Une onde de pression dynamique
appelée "souffle" qui se propage à l'extérieur de la masse explosive.
- Un dégagement de chaleur appelé
"flux thermique".
On
donne pour caractériser l'explosif, sa vitesse de détonation qui est la vitesse
de déplacement du front de l'onde de choc produite ; elle dépend de la densité
de l'explosif.
Ainsi
pour le PETN (tétranitrate de pentaérythritol) elle est de
- 8400 m.s-1 si la
densité est 1,77
- 7900 m.s-1 si la
densité est 1,62
- 7420 m.s-1 si la
densité est 1,50
La réaction
de décomposition de l'explosif correspond à une combustion, les atomes
d'oxygène étant fournis par la molécule elle-même.
Cette
combustion sera complète et conduira à CO2 et H2O si z =
2x+y/2 en considérant que la formule moléculaire de l'explosif est CxHyOzNv
.
On dira
qu'il est
- Sur-oxygéné si z >2x+y/2
- Sous-oxygéné si z<2x+y/2
On parle parfois de bilan oxygène :
- Si la quantité d'oxygène est juste
suffisante pour une combustion complète on dit que le bilan oxygène est nul.
- Si la quantité d'oxygène est
insuffisante pour une combustion complète on dit que le bilan oxygène est
négatif.
- Si la quantité d'oxygène est
excédentaire on dit que le bilan oxygène est positif.
Il a
été montré que la sensibilité de l'explosif ainsi que sa force et sa brisance
(capacité à briser) dépend de plusieurs facteurs et en particulier du bilan
oxygène, et que l'explosif est d'autant plus sensible, fort et brisant que son
bilan oxygène se rapproche de 0.
3) Quelques molécules très instables
|
Acétylène
et acétylures Acétylène C2H2
A
noter que la décomposition de ces
acétylures métalliques ne dégage aucun gaz
|
L'acétylène
gazeux est instable ; mais cette instabilité dépend de la pression.
Les acétylures métalliques (d'argent,
de cuivre, de mercure ……) secs sont très explosifs ; ils sont sensibles aux
chocs et à une élévation de température. Ils détonent et pour l'acétylure
d'argent par exemple, la vitesse de détonation est d'environ 4000 m.s-1. |
|
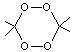
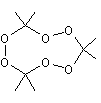
Peroxyde
d'acétone (TATP) Forme dimère
Forme
trimère
|
Le peroxyde d'acétone se présente comme une poudre
blanche insoluble dans l'eau, légèrement soluble dans l'éthanol et soluble
dans l'acétone, l'éther, l'hexane, le benzène. La forme trimère majoritaire est particulièrement
instable et explose au contact d'un filament incandescent, sous l'effet d'un
choc ou par friction. Cette molécule constitue un explosif appelé TATP
(TriAcétone TriPeroxyde). Elle peut être préparée à froid par action du
peroxyde d'hydrogène (eau oxygénée) sur la propanone (acétone) avec H2SO4
comme catalyseur. La vitesse de détonation est de 5300 m.s-1. Les formules moléculaires sont : - Pour la forme dimère C6H12O4 - Pour la forme trimère C9H18O6 Dans
les deux cas cet explosif est sous-oxygéné. |
|
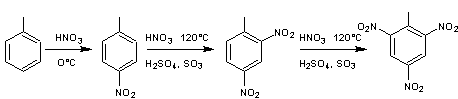
Trinitrotoluène
(TNT)
C7H5
N3O6 |
Cette
molécule est prise comme standard lorsqu'on souhaite mesurer l'importance d'une
explosion ou la puissance d'une bombe que l'on exprime en équivalent en TNT
(kilotonne ou mégatonne). C'est
un solide cristallisé légèrement jaunâtre qui peut être préparé par nitration
du toluène :
Les
deux dernières étapes ont lieu avec un mélange acide nitrique, oléum (H2SO4,
SO3). Ce
composé est peu sensible aux chocs ; on peut même le faire brûler sans
explosion (il explose lorsqu'il est porté à 240°C). C'est
un explosif sous-oxygéné. Lorsqu'on
l'utilise comme explosif, il faut utiliser un détonateur, c'est-à-dire une
petite charge qui en explosant permet de déclencher la détonation de la
charge explosive principale. La
vitesse de détonation du TNT est de 6900 m.s-1. Une de ses réactions de décomposition :
|
|
Nitrate
de cellulose ou "Nitrocellulose"
|
HNO3 peut estérifier les fonctions alcool de la cellulose
pour donner le nitrate de cellulose. Le nitrate de cellulose à 12% d’azote (2 NO2 par motif -
attaque des OH secondaires-) dissous dans un mélange alcool-éther, donne un
liquide sirupeux (collodion) ; ce produit, mélangé à du camphre en solution
dans l’alcool donne une pâte qui, après évaporation de l’alcool, devient le
celluloïd ; utilisation : balles de ping-pong. |
|
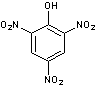
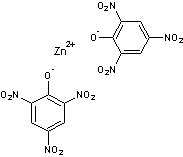
Acide
picrique ou 2,4,6-trinitrophénol et les
picrates. Acide picrique
Picrate de zinc
|
Les
picrates notamment des métaux lourds et de transition tels que Ni, Pb, Hg Cu
et Zn sont explosifs par chocs et frictions. L'acide picrique est un peu moins
sensible aux chocs ou aux frottements et ce d'autant moins qu'il est humide ;
il est en conséquence vendu solide avec 35% d'humidité. Le produit sec
explose à une température supérieure à 300°C (322°C). La
vitesse de détonation est d'environ 7300
m.s-1. L'acide
picrique (C6H3N3O7) a été utilisé
comme explosif sous le nom de mélinite. Son
nom est parfois abrégé en TNP (TriNitroPhénol). C'est
un explosif sous-oxygéné. |
|
N,2,4,6-tétranitro-N-méthylaniline ou Tétryl
|
Nitramine
qui se présente en poudre jaune cristallisée. C'est
un explosif plus sensible au frottement, au choc ou aux étincelles que le TNT
; il se rapproche dans ce domaine de l'acide picrique. Il est instable dans le
temps, mais peut avec quelques précautions être stocké. Il a été utilisé dans
les détonateurs, mais n'est plus guère utilisé dans les munitions
aujourd'hui. Sa
vitesse de détonation est de 7570 m.s-1 pour une densité de 1,73. Sa
formule moléculaire C7H5N5O8. C'est
un explosif sous-oxygéné. |
|
ou Nitroglycérine
C3H5N3O9 |
Liquide
à la température ordinaire, très instable, qui peut, par choc ou élévation de
température donner lieu à la transformation explosive suivante
1
mole de nitroglycérine donne naissance à 7,25 moles de gaz ce qui est
considérable. L'explosion
libérant du dioxygène, on peut dire que c'est un explosif sur-oxygéné. Placé
sur un support absorbant et inerte, le trinitrate de glycérol est stabilisé
et constitue la dynamite. La
molécule a été découverte par un chimiste italien Ascanio Sobrero (Université
de Turin) en 1847. La fabrication industrielle a été mise au point par Alfred
Nobel en 1860 ; ce même industriel a découvert en 1866 comment stabiliser cet
explosif grâce à un support d'origine naturelle le kieselguhr. Sa
vitesse de détonation est de 7700 m.s-1. Il
est obtenu par nitration du glycérol. |
|
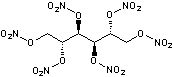
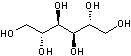
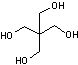
Hexanitrate de mannitol ou Hexanitromannitol
C6H8N6O18 |
Explosif
puissant. C'est un solide à température ordinaire. On le
connaît aussi sous le sigle MHN (abréviation de son nom anglais Mannitol
HexaNitrate). Il est
fabriqué par nitration du mannitol
Plus
stable que la nitroglycérine, on l'utilise dans les détonateurs. Sa
vitesse de détonation est de 8260 m.s-1. C'est
un explosif sur-oxygéné. |
|
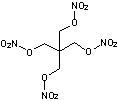
Tétranitrate
de pentaérythritol ou PETN ou Penthrite
C5H8
N4O12 |
Explosif
dont la structure rappelle celle de la nitroglycérine. C'est
un solide blanc cristallisé qui a été préparé en laboratoire en 1894 à Cologne
(Allemagne) puis fabriqué à partir de 1912 ; il a été utilisé pendant les
deux guerres mondiales pour la fabrication de mines. Il
peut être obtenu par nitration (action de l'acide nitrique concentré) sur le
pentaérythritol
C'est
un explosif moyennement sensible aux chocs et aux frottements. C'est
un explosif sous-oxygéné. Sa
vitesse de détonation est 8400 m.s-1 pour une densité de 1,77. Cet
explosif est surtout utilisé pour ses effets brisants. Le
volume de gaz produit par l'explosion de 1 kg de PETN est d'environ 780 L. |
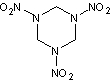
|
ou Hexogène ou RDX (acronyme de Research
Department eXplosive) ou Cyclonite
C3H6N6O6 |
Fabriquée
par action de l'acide nitrique sur l'hexaméthylènetétramine (urotropine)
cette
molécule correspond à un solide cristallisé blanc. C'est un puissant explosif
qui se décompose à 217°C suivant l'équation
C'est
un explosif sous-oxygéné. Sa
vitesse de détonation est 8750 m.s-1 pour une densité de 1,76. 1kg
de RDX dégage environ 900L de gaz en explosant Il
est utilisé à des fins militaires. |
|
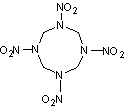
Cyclotétraméthylène
tétranitramine ou HMX
(High Melting point eXplosive) ou Octogène
|
C'est
un explosif à point de fusion élevé ; en effet c'est un solide blanc (C4H8N8O8)
qui fond à 285°C. Il
est plus stable que le RDX thermiquement mais il est
sensible aux chocs. C'est
un explosif sous-oxygéné. Il
est très puissant ; sa vitesse de détonation est environ de 9100 m.s-1
pour une densité de 1,91. On
l'obtient par action de l'acide nitrique concentré sur l'hexaméthylènetétramine,
comme le RDX donc, mais en présence d'acide éthanoïque concentré et de
nitrate d'ammonium. Il
est réservé à des usages militaires souvent comme détonateur. |
|
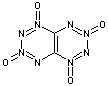
Tétrazino-tétrazine-1,3,6,8-tétraoxyde ou TTTO
|
Cet
explosif de nouvelle génération se présente comme un solide jaune en poudre
de grande densité (1,98) ; il résulte de la fusion de deux tétrazines ; sa
molécule de formule C2N8O4 est très
symétrique et ne contient pas d'atome d'hydrogène. Sa
décomposition produit du dioxyde de carbone et du diazote
La
quantité d'oxygène présente dans sa molécule permet une combustion complète. Sa
vitesse de détonation est d'environ 9700 m.s-1. |
|
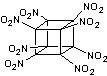
C8N8O16 |
C'est
un des explosifs non nucléaires les plus puissants, de nouvelle génération. L'instabilité
de cette molécule est due à plusieurs facteurs - La
présence de nombreux groupes nitro - à
la grande tension des cycles qui constituent le squelette carboné. Paradoxalement
il se révèle peu sensible aux chocs ainsi qu'à la chaleur. Il
est difficile à synthétiser du fait de l'instabilité de son squelette carboné
et reste pour l'instant une curiosité de laboratoire. Il a
été obtenu pour la première fois par deux chercheurs de l'Université de
Chicago en 1999. De
formule C8N8O16 on remarque qu'il n'y a pas
d'atome d'hydrogène dans sa molécule. Sa densité est 1,98 c'est-à-dire très
importante pour un composé organique ; sa décomposition produit du dioxyde de
carbone et du diazote
La
quantité d'oxygène présente dans sa molécule permet une combustion complète. Sa
vitesse de détonation est de 10100 m.s-1. |
Certaines
des molécules ci-dessus sont utilisées à des fins industrielles ou militaires.
On ajoute
alors à la matière explosive, des substances qui vont conférer à l'ensemble des
propriétés particulières adaptées à leur utilisation.
La
composition générale d'un "plastic" par exemple est :
- La matière explosive
- Un liant
- Un plastifiant
- Parfois d'autres substances
(dispersant, antioxydant, colorant et autres marqueurs ….).
Remarque :
- Le liant est généralement un polymère dans lequel la
molécule explosive est noyée et qui a des propriétés stabilisatrices ; il
évite une explosion intempestive ; c'est ce qu'on appelle en terme
militaire la muratisation de la charge. Le liant améliore aussi les
performances de l'explosif en termes de détonation ou de combustion.
- Le plastifiant permet au polymère liant d'être
malléable. On dit alors que cette préparation est un plastic (mot emprunté
à l'anglais).
- Le dispersant facilite la dispersion de l'explosif
dans le liant.
- L'antioxydant évite, en réagissant avec les radicaux
peroxyde qui se forment à l'air et à la lumière, que ceux-ci n'aillent
réagir avec l'explosif.
- Les marqueurs de détection permettent, par les
vapeurs qu'ils émettent, de déceler leur présence avant et après
explosion.
- Le colorant quand il existe permet de différencier
certains explosifs (par exemple le SEMTEX A est coloré en rouge brun par
le Sudan IV, alors que le SEMTEX H est coloré en orangé par le Sudan I
(voir annexe 7)).
Exemple
1
Explosif
C4
- Matière explosive RDX (91%)
- Liant Polyisobutylène (voir annexe 8)
- Plastifiant Adipate ou
Sébaçate de bis-2-éthylhexyle (voir annexe 4)
- Dispersant Huile minérale
(huile moteur sans détergent)
- Marqueur de détection DMNB
(voir annexe 9)
Exemple
2
Explosif
SEMTEX A (Utilisé pour la démolition)
- Matière explosive PETN
(94,3%) + RDX (5,7%)
- Liant Gomme styrène-
butadiène (SBR voir annexe 3)
- Plastifiants Phtalate de
di-n-octyle et citrate de tri-n-butyle (voir annexe 5)
- Antioxydant
N-phényl-2-naphtylamine (voir annexe 6)
- Colorant Sudan IV
(voir annexe 7)
- Dispersant Huile de
paraffine
- Marqueur de détection
Ethylène glycol dinitrate (EGDN) ou orthonitrotoluène (voir annexe
10)
C'est
un explosif du type brisant découvert et fabriqué dans les années 1960 par une
firme (Semtim) située en République Tchèque.
Son nom
vient de SEMT (4 premières lettres du nom de la firme) et EX (explosif).
Au
début cette préparation était très difficile à détecter ; Dans les années 1990,
le fabricant a été obligé, pour permettre une identification plus rapide, de
mettre des marqueurs : dinitrate d'éthylène glycol, orthonitrotoluène …. ainsi
qu'un colorant.
Il
existe un autre SEMTEX (Le H) dont la composition en matière explosive est
différente (environ 50% de PETN et 50% de RDX).
Enthalpie de décomposition et
chaleur de combustion.
·
Comparons
les enthalpies de décomposition de l'éthyne, l'éthène et l'éthane :

·
Il ne faut pas confondre l'enthalpie de
décomposition et la chaleur de combustion d'un corps ; cette dernière
correspond à l'opposé de l'enthalpie de réaction de ce corps avec le dioxygène
; c'est la chaleur dégagée par la réaction de combustion :
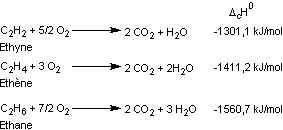
Ainsi
les chaleurs dégagées lors de la combustion d'une mole d'éthyne, d'une mole
d'éthène et d'une mole d'éthane sont respectivement 1301,1 kJ, 1411,2 kJ et
1560,7 kJ.
Remarque :
Il est à
noter que la température de flamme de l'éthyne (1800°C et même 3000°C dans le
chalumeau oxy-acétylénique) est plus élevée que celles obtenues avec les deux
autres gaz. Cela peut paraître paradoxal dans la mesure où la chaleur de
combustion de l'éthyne est la plus faible. En fait on se rend compte que la
quantité d'eau formée dans les réactions de combustion est la plus faible pour
l'éthyne (1 mole contre respectivement 2 et 3 moles pour les autres). La
quantité de chaleur (puisée dans la chaleur de combustion) nécessaire pour
vaporiser cette eau est donc plus faible pour l'éthyne que pour les deux
autres. La quantité de chaleur qui participe à la température de la flamme de
l'éthyne est au total plus importante.
Formation
d'hydroperoxyde de diéthyléther dans un flacon d'éther.
Le
dioxygène sous l'effet des UV conduit à un biradical (A). Il induit la rupture homolytique
d'une liaison C-H d'une molécule d'éther ; celle-ci devient donc aussi un
radical (B). L'union de (B) et d'un autre biradical (A) conduit à (C) qui
s'unit à un atome d'hydrogène pour donner un hydroperoxyde. Des liaisons
hydrogène se forment entre les molécules d'hydroperoxyde et cette substance se
concentre.
L'hydroperoxyde
est un composé très instable ; à la lumière et à la chaleur la liaison O-O
subit une rupture homolytique en donnant deux radicaux qui sont de nouveaux
points de départ de réactions en chaînes.
C'est
ainsi qu'on explique le fait que l'auto-oxydation de l'éther est amplifiée par
la présence de peroxydes.
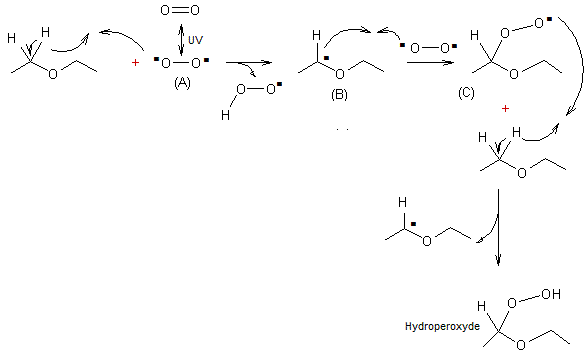
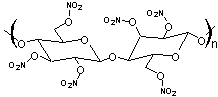
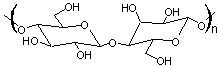
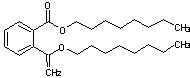
Gomme styrène-butadiène (SBR)
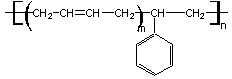
Il s'agit d'un copolymère
styrène-butadiène ; suivant le nombre d'unités butadiène et styrène on aura un
caractère élastomère plus marqué (avec une grande majorité de butadiènes) ou thermoplastique
plus marqué (avec une grande majorité de styrènes) ; dans le premier cas
rappelons que le SBR sert à fabriquer des pneus de tourisme.
Elle sert de liant aux explosifs
Semtex.
|
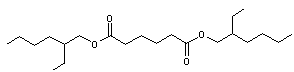
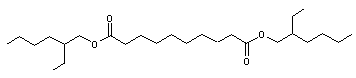
Adipate de
bis-2-éthylhexyle |
Sébaçate de
bis-2-éthylhexyle |
|
|
|
Ces deux
substances jouent le rôle de plastifiant pour l'explosif C4, c'est-à-dire
qu'elles rendent la matière de l'explosif malléable.
|
Phtalate de di-n-octyle |
Citrate de tri-n-butyle |
|
|
|
Ces deux
substances jouent le rôle de plastifiant pour les explosifs SEMTEX,
c'est-à-dire qu'elles rendent la matière de l'explosif malléable.
N-phényl-2-naphtylamine
![]()
C'est l'antioxydant des SEMTEX.
Sudan IV et Sudan I
-
Sudan IV
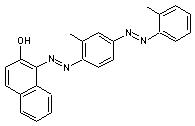
Colorant rouge brun soluble dans les
huiles, graisses et cires qui a été utilisé comme colorant alimentaire.
C'est un produit aidant à
l'identification de l'explosif Semtex A.
-
Sudan I
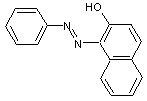
Colorant orangé soluble dans les
huiles, graisses et cires qui a été utilisé comme colorant alimentaire mais un
tel usage est interdit depuis 1995 car c'est une molécule mutagène et
cancérigène.
C'est un produit aidant à
l'identification de l'explosif Semtex H.
Polyisobutylène
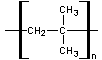
Cette molécule sert de liant à
l'explosif C4.
DMNB
(2,3-DiMéthyl-2,3-diNitroButane)
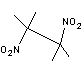
C'est un marqueur de détection pour
l'explosif C4.
Les vapeurs émises par cette
molécule sont détectées par des instruments ou par des chiens spécialement dressés
à cet effet qui en perçoivent l'odeur à des concentrations extrêmement faibles
(0,5 partie par billion (1012) dans l'air !
EGDN (DiNitrate d'Ethylène Glycol)
![]()
ou Orthonitrotoluène
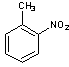
Ces deux molécules sont des
marqueurs de détection pour les explosifs SEMTEX.