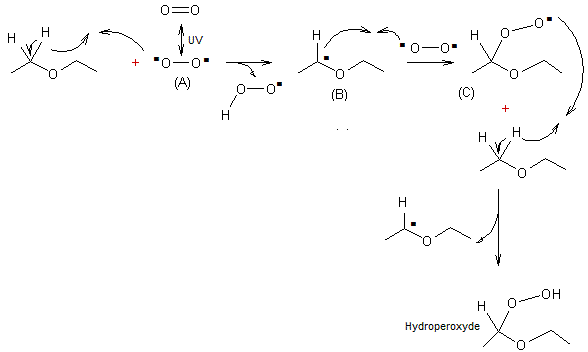LES PEROXYDES D'ETHER
Wolfgang Werner, Münster
Les peroxydes d'éther se sont fait remarquer, dans le
passé, lors d'explosions au cours de manipulations de l'éther. Leur présence
n'était pas intentionnelle et en général, elle n'est jamais souhaitée.
Par action de l'acide sulfurique sur l'éthanol, on
obtient une substance à odeur caractéristique, dont les vapeurs peuvent être
condensées à 35°C en un liquide incolore. Les vapeurs ont une densité
supérieure à celle de l'air ; elles ressemblaient tellement à l'éther grec que
Johann Sigismund Frobenius, en 1730, appela cette substance spiritus aethereus.
Pendant longtemps l'éther
diéthylique a été appelé éther sulfurique à cause de la façon dont on
l'obtenait, alors même qu'il ne contient pas de soufre.
L'éther selon les grecs,
devait remplir l'univers, ce que les physiciens ont adopté ; ils pensaient même
qu'il servait à la propagation de la lumière.
En 1846, le dentiste
Th.G.Morton découvre l'effet "narcotisant" de l'éther et l'applique
dans son cabinet. La même année, le chirurgien de Boston C.J.Warren opère un
patient endormi à l'éther et ainsi commence la marche triomphale de
l'anesthésie à l'éther.
Les vapeurs sont très facilement inflammables et les
mélanges vapeur d'éther-air peuvent entraîner de fortes explosions. L'éther
n'est pas miscible à l'eau ; il peut donc être utilisé comme solvant pour
certaines extractions ; il ne faut cependant pas lors de ces opérations,
rejeter la phase aqueuse dans un évier, car l'éther est un peu soluble dans
l'eau (69 g/L) et les vapeurs qui s'échappent de ce mélange peuvent suffire à
provoquer des explosions. Pour ces raisons, mais aussi pour des considérations
médicales, l'anesthésie par l'éther est aujourd'hui abandonnée.
La distillation est une méthode simple de purification
des liquides. Appliquée à de vieux échantillons d'éther, elle a parfois conduit
à de fortes explosions. En recherchant les causes de ces phénomènes, on s'est
aperçu que ces vieux échantillons coloraient en bleu une solution aqueuse
d'iodure de potassium et d'amidon. La raison de cette coloration est qu'au
contact de cet éther, des ions iodures sont oxydés en iode, qui, avec les ions
iodures restants donnent des ions I3- (triiodures) qui
s'insèrent dans l'hélice de l'amylose, un composant de l'amidon, provoquant la
coloration bleue (figure 1).Cette réaction n'étant pas
très fiable, on peut faire appel à un autre réactif facilement accessible à
base de titanyl (IV) et l'on s'aperçoit qu'au contact de vieux échantillons
d'éther il y a formation d'un complexe orangé de [peroxotitane (IV)], preuve
que ces échantillons sont oxydants ; ce sont les peroxydes formés par
auto-oxydation de l'éther qui leur donnent ces propriétés.
Au début on stockait
l'éther dans des bouteilles brunes parce qu'on pensait que c'était la lumière
qui déclenchait l'auto-oxydation. Le mécanisme de cette réaction est décrit
dans la figure 2. Le dioxygène est un biradical (A). Il
induit la rupture homolytique d'une liaison C-H d'une molécule d'éther ;
celle-ci devient donc aussi un radical (B). L'union de (B) et d'un autre
biradical (A) conduit à (C) qui s'unit à un atome d'hydrogène pour donner un
hydroperoxyde. Des liaisons hydrogène se forment entre les molécules d'hydroperoxyde
et cette substance se concentre dans le résidu de la distillation de l'éther.
L'hydroperoxyde est un
composé très instable ; à la lumière et à la chaleur la liaison O-O subit une
rupture homolytique en donnant deux radicaux qui sont de nouveaux points de
départ des réactions en chaînes.
C'est ainsi qu'on explique
le fait que l'auto-oxydation de l'éther est amplifiée par la présence de
peroxydes.
Il est évident qu'en
excluant l'oxygène de l'air on peut empêcher l'auto-oxydation et que le stockage
à froid peut freiner la réaction en chaîne.
Avant d'utiliser l'éther,
il faut l'agiter avec une solution acide de sulfate de fer (II) afin d'éliminer
les peroxydes. Mais en même temps il va se saturer en eau (1,25%) ; il ne peut
donc plus être utilisé dans certaines réactions qui nécessitent de l'éther
anhydre, comme par exemple les réactions de Grignard.
Il est possible de réduire
les peroxydes en évitant l'eau ; pour cela on traite l'éther par du chlorure de
cuivre (I) qui, avec des chlorures de tétra-alkylammonium, forme des complexes
de [trichlorocuivre (I)] solubles dans l'éther et qui réduisent les peroxydes.
On peut ajouter ces réactifs à l'éther à purifier et distiller celui-ci sans
danger d'explosion.
Ce procédé peut également
être appliqué à l'éther cyclique tétrahydrofurane. On a trouvé des peroxydes
dans un bidon métallique, totalement opaque à la lumière, contenant du
tétrahydrofurane. Ce sont les rayonnements cosmiques qui traversant la matière
du bidon ont initié la formation des radicaux. Il ne faut pas sous-estimer cet
effet lorsqu'on cherche à expliquer l'auto-oxydation de l'éther.
Figure 1
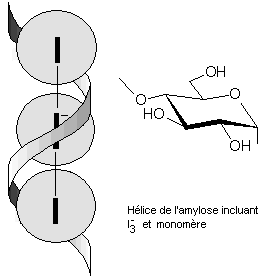
Figure 2