ETHERPEROXIDE
Wolfgang
Werner, Münster
Die Etherperoxide
haben durch Explosionen auf sich aufmerksam gemacht. Ihre Synthese war und ist
nicht beabsichtigt.
Durch Reaktion von Schwefelsäure auf Ethylalkohol wird eine Substanz von einem
charakteristischen Geruch erhalten, deren Dämpfe sich bei 35° zu einer
farblosen Flüssigkeit kondensieren lassen. Johann Sigismund Frobenius
bezeichnete 1730 die Substanz von höherer Dichte als Luft in Anlehnung an die
Vorstellung alten Griechen von Äther als spiritus aethereus. Auch der Name Schwefeläther, von der Herstellung
bedingt, wurde lange verwendet, obwohl die Substanz keinen Schwefel enthält.
Die Dämpfe haben eine höhere Dichte als Luft und breiten sich scheinbar
grenzenlos aus. Sie entsprachen derart dem griechischen Äther, dass dieser zum
Namensgeber wurde.
Auch die Physik bediente sich des
griechischen Ätherbegriffs, er sollte das Weltall ausfüllen und als Medium für
die Ausbreitung des Lichts dienen.
1846 entdeckte der Zahnarzt Th.G. Morton die narkotisierende Wirkung von Ether und
nutzte diese Wirkung in seiner Praxis. Im gleichen Jahr führte der Bostoner
Chirurg C.J. Warren eine Operation an einem mit Ether narkotisierten Patienten
durch, und leitete damit den Siegeszug Etheranästhesie
um die Welt ein. Da Etherdämpfe sehr
leichtentzündlich sind, haben Ether-Luft-Gemische zu schweren Explosionen
geführt. Nicht nur wegen dieser Gefahr sondern auch aus medizinischen Gründen
hat man heute die Ethernarkose verlassen.
Im Laboratorium ist Diethylether ein beliebtes Lösungsmittel. Da es sich nicht
mit Wasser mischt wird es gerne für Extraktionen verwendet. Selbst wenn die
wässrige Phase verworfen wird, sollte man bedenken, dass Ether in Wasser etwas
löslich ist (69g/L) und daraus auch im Ausguss Etherdämpfe
entweichen, die wegen der Leichtentzündlichkeit eine erhebliche Gefahrenquelle
darstellen.
Die Destillation ist im Prinzip eine
einfache Methode zur Reinigung von Flüssigkeiten. Bei der Destillation von altem
Ether ist es zu heftigen Explosionen gekommen. Auf der Suche nach der Ursache
fand sich, dass eine wässrige Kaliumiodid-Stärke-Lösung sich im Kontakt mit
altem Ether blau färbte. Jodid wurde zu elementarem Iod oxidiert, das sich mit
Iodid zu Triiodid verbindet, das in die Helix der Amylose (Bestandteil der Stärke) unter Blaufärbung
eingelagert wird. (Abb.1) Die Reaktion ist störanfällig.
Die Bildung eines orangefarbenen Peroxotitanyl(IV)-Komplexes
aus einem leicht zugänglichen Titanyl-Reagenz im
Kontakt mit altem Ether führt zu dem eigentlichen Oxidationsmittel darin. Ether
wird in braunen Flaschen aufbewahrt, weil man annahm, dass Licht die
Autooxidation auslöst, bzw. begünstigt. (Abb.2) Am Anfang der
Autooxidation steht ein Radikal, das mit Sauerstoff (ein Biradikal)
ein weiteres Radikal bildet, das durch Abstraktion eines H-Atoms ein
Hydroperoxid bildet. Hydroperoxide sind in der Lage Wasserstoffbrückenbindungen
einzugehen, was erklärt, dass Hydroperoxid sich bei der Destillation von Ether
im Rückstand anreichert. Hydroperoxid ist eine sehr labile Verbindung, die
durch Licht und Wärme durch Spaltung der O-O- Bindung in zwei Radikale
zerfällt, die wiederum Ausgangspunkt für die Kettenreaktion der Autooxidation
darstellen. Das erklärt, dass peroxidhaltiger Ether
die weitere Autooxidation begünstigt. Es ist offensichtlich, dass der
Ausschluss des Luftsauerstoffes die Autooxidation verhindern kann. Kühle
Lagerung kann die Kettenreaktion bremsen.
Vor der
Verwendung des Ethers muss man diesen durch Schütteln mit einer sauren
Eisen(II)sulfat-Lösung von Peroxiden befreien.
Gleichzeitig wird der Ether mit Wasser gesättigt(1,2%), was den Ether für
verschiedene Verwendungszwecke z.B. Grignard-Reaktion, ungeeignet macht.
Eine
Reduktion bei der Wasser vermieden wird bedient sich Kupfer(I)chlorid, das mit Tetraalkylammoniumchlorid
etherlösliches Trichlorocuprat(I)bildet,
das Peroxiden reduziert.
Man kann den
zu reinigenden Ether mit den Reagenzien versetzen und gefahrlos den reinen
Ether abdestillieren.
Das Verfahren
ist auch für den zyklischen Ether Tetrahydrofuran
geeignet.
In
einem Blechkanister, der sicher völlig lichtundurchlässig ist, wurde THF mit
erheblichem Peroxidgehalt gefunden. Offenbar darf der
Einfluss der kosmischen Strahlung, deren Weg durch Materie durch Radikalbildung
gekennzeichnet ist, auf die Autooxidation nicht unterschätzt werden.
Abb. 1,
Amylosehelix
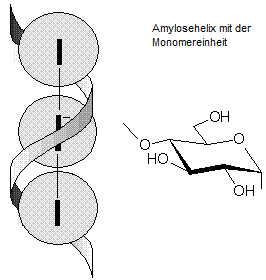
Abb. 2,
Autooxidation
