ESPECES
REACTIVES DE L'OXYGENE
d'après
le sujet AIPC 2007 (Chimie agrégation interne)
Plan de l'étude
2-1)
Représentation
2-2)
Indice de liaison des atomes
2-3)
Transformation en peroxyde d'hydrogène
Directement
issues de la molécule de dioxygène, diverses espèces réactives (telles que le
dioxygène singulet et l'anion superoxyde), sont normalement produites à dose
raisonnable et contrôlée par les organismes vivants. Ces espèces et les
radicaux qu'ils génèrent (radical hydroxyle par exemple) bien qu'indispensables
à la vie, sont aussi responsables, en cas de production excessive, de la
majorité des dégradations touchant les biomolécules (oxydation des lipides, des
protéines, de l'ADN). Cette surproduction est appelée "stress
oxydant".
Outre
leur implication dans les milieux vivants, les espèces réactives du dioxygène
(ou ERO), l'ozone notamment, sont à l'origine de la dégradation des matériaux
plastiques.
Voir
également "Radicaux et anti-radicaux".
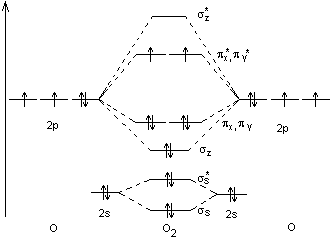
La
structure électronique de valence de l'atome d'oxygène est 2s2 2p4.
Le
diagramme énergétique des orbitales moléculaires de la molécule de dioxygène
est le suivant :
La
représentation de Lewis de la molécule O2 :
![]()
Cette
structure, contrairement aux diagrammes des orbitales moléculaires, ne rend pas
compte de la présence de 2 électrons célibataires sur la molécule.
On le
désigne par O2- ou quelques fois par O2°-
:
L'anion
superoxyde O2- possède un électron de plus que O2.
Sa structure électronique est donc :
(σs)2(σ*s)2
(σz)2(πxπy)4(π*xπ*y)3.
Dans
l'écriture O2°- le point indique la présence d'un
électron célibataire (espèce radicalaire) et le "-" indique qu'il y a
un électron de valence supplémentaire par rapport à O2.
2-2) Indice
de liaison des atomes
Rappel : On appelle indice
de liaison, la valeur calculée, entière ou décimale, du nombre de paires
d’électrons liant deux atomes par référence à une liaison simple.
Dans O2
l'indice de liaison est 2 tandis que dans O2- il n'est
que de 1,5. La liaison dans O2 est donc plus forte que dans O2-.
Il en résulte que la distance interatomique de l'anion superoxyde est plus
grande que celle de la molécule de dioxygène.
2-3) Transformation
en peroxyde d'hydrogène
Dans
les milieux vivants, une enzyme (la superoxyde dismutase), catalyse la
transformation de l'anion superoxyde en peroxyde d'hydrogène. La réaction mise
en jeu est une réaction de dismutation et conduit simultanément à la formation
de dioxygène.
Les
demi-équations rédox et l'équation bilan de la transformation s'écrivent :
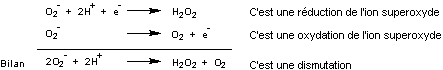
En
milieu neutre :
![]()
Le
diagramme énergétique des orbitales moléculaires du radical hydroxyle HO° est
le suivant :
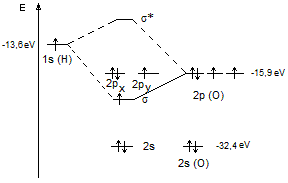
La
structure de Lewis de ce radical :
![]()
Comme
dans les diagrammes des orbitales moléculaires on retrouve :
- 1
liaison s entre les deux
atomes
- 2
orbitales moléculaires non liantes sur O
- 1
électron célibataire sur O.
La
molécule de dioxygène à l'état fondamental est dans un état triplet.
En se
référant au diagramme moléculaire de l'oxygène représenté ci-dessus
en 1) on s'aperçoit qu'elle possède 2 électrons non appariés avec des spins
parallèles dans les orbitales moléculaires π*.
On a donc
un spin total S = 2 x 1/2 = 1 et une multiplicité de spin a = 2S + 1 = 3, ce
qui correspond bien à un état triplet.
La
molécule de dioxygène possède deux états électroniques excités notés 1Dg et 1Sg+ dont les niveaux
d'énergie par rapport à l'état fondamental sont représentés ci-dessous :
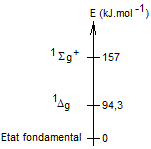
Ce sont
deux états singulets comme on le voit ci-dessous :
- 1er Etat singulet
:
![]()
- 2ème Etat singulet
:
![]()
L'état 1Dg a une durée de vie
suffisante pour participer à des réactions photosensibilisées impliquées
notamment dans les processus biologiques.
5) L'ozone
L'ozone
O3 fait partie des polluants présents à basse altitude et
responsables de la dégradation oxydante des polymères insaturés tels que le
polybutadiène.
Sa
formule de Lewis et ses formes mésomères sont :
![]()
Le
modèle VSEPR nous montre que cette
molécule est de type AX2E ce qui correspond à une figure de
répulsion trigonale plane et une géométrie coudée avec un angle proche de 120°.
Géométrie :
![]()
Le
moment dipolaire de la molécule d'ozone est dirigé selon l'axe de symétrie de
la molécule :
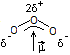
Remarque :
Le polybutadiène
est un polymère insaturé
![]()
L'ozone
peut le dégrader en réagissant sur les doubles liaisons (coupure oxydante par
ozonolyse) :
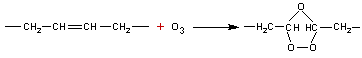
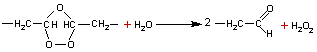
Les
produits formés sont des aldéhydes.