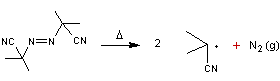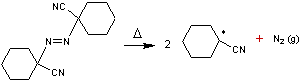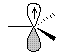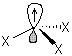RADICAUX
ET ANTI-RADICAUX
Gérard Gomez
Plan de l'étude
1) Les radicaux
1-1)
Définition – Historique - Exemples
1-2)
Les radicaux en chimie organique
1-2-1)
Durée de vie des radicaux
1-2-2)
Formation des radicaux
1-2-3)
Les additions radicalaires
1-2-4)
Les substitutions radicalaires
1-2-5)
Les cyclisations radicalaires
1-3)
Les radicaux dans l'atmosphère
1-3-1)
Formation des principaux radicaux de l'atmosphère
1-3-2)
Rôle des radicaux hydroxyle et nitrate dans l'atmosphère
1-4)
Les radicaux et le vivant
1-4-1)
Les espèces réactives de l'oxygène (ERO)
1-4-2)
Le stress oxydant
1-4-3)
Des effets bénéfiques des radicaux
Annexe 1
Définition d'une entité moléculaire
Annexe 2
Gomberg et les radicaux
Annexe 3
Stéréosélectivité de l'addition d'un halogénure d'hydrogène sur une double
liaison carbone-carbone
Annexe 4
Différents types de radicaux
Annexe 5 Des
généralités sur les oxydes d'azote
Annexe 6 Les
différentes "couches de l'atmosphère"
Annexe 7 COV,
COVNM
Annexe 8
L'oxygène singulet
Annexe 9 Le
glutathion
1-1) Définition –
Historique - Exemples
- Définition : Ce sont des
entités moléculaires (voir
annexe 1) possédant un ou plusieurs électrons non
appariés (voir annexe 4) provenant d'une rupture homolytique d'une
liaison covalente faible.
Remarques :
·
Dans la formule d'un radical
l'électron non apparié est représenté par un point placé à droite du symbole de
l'élément ou du groupe (Exemple CH3° ).
·
Ces substances possèdent un
paramagnétisme de spin qui peut servir à les détecter.
Historique :
C'est
Gomberg (1866-1947), un chercheur de l'Université du Michigan qui pour la
première fois (voir
annexe 2) mit en évidence un radical, le triphénylméthyle, une
entité à "carbone trivalent".
Quelques exemples de radicaux
:
|
|
|
|
|
|
|
Carboradical |
Anion
superoxyde |
Radical
hydroxyle |
Monoxyde
d'azote |
Radical
Chlore |
1-2) Les radicaux
en chimie organique
1-2-1) Durée
de vie des radicaux
Les
radicaux ont en général des durées de vie très courtes, ce sont la plupart du
temps des intermédiaires de réactions et ils peuvent disparaître de plusieurs
façons :
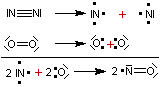
- Par recombinaison en
réagissant avec un autre radical
![]()
Si deux radicaux identiques se recombinent,
c'est une dimérisation
![]()
- En réagissant avec une
molécule pour créer un autre radical
![]()
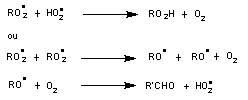
-
Par dismutation
![]()
- Par oxydo-réduction
![]()
s'il y
a perte ou gain d'un électron.
Certains
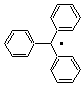
radicaux sont relativement stables, c'est le cas du triphénylméthyle, le
radical découvert par Gomberg, dont la durée de vie se chiffre en semaines.
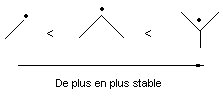
La
stabilité d'un radical est liée :
a) au degré de
substitution du carbone radicalaire
Ainsi
un radical primaire est moins stable qu'un radical secondaire, lui-même moins
stable qu'un radical tertiaire :
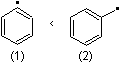
b) à la mésomérie,
un radical est stabilisé par résonance
Ainsi
dans l'exemple ci-dessous le radical (1) est moins stable que le radical (2)
en
effet dans le radical (2) on observe une délocalisation importante de l'électron non apparié :
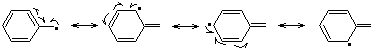
Un
radical peut aussi être stabilisé par interaction avec
- des substituants
électroattracteurs comme C=O ou COOR
- des substituants électrodonneurs
comme O, N, Cl, F …..
c) à l'encombrement
stérique autour du centre radicalaire
Ainsi
l'exemple ci-dessous le radical (1) est moins stable que le radical (2)
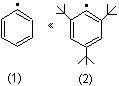
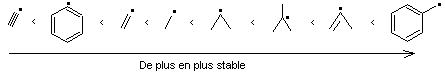
La
liste ci-dessous donne un aperçu de la stabilité relative de quelques radicaux
organiques :
On peut
enfin donner deux radicaux persistants :
- En chimie organique
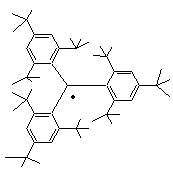
C'est
l'encombrement stérique de la molécule qui empêche le radical de réagir et le
rend persistant.
- En chimie inorganique
L'oxygène
moléculaire gazeux ordinaire est un diradical persistant.
La
molécule
![]()
pourrait
s'écrire
![]()
Ce
sujet sera repris en annexe 8
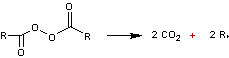
Lorsqu'on
souhaite produire des radicaux au cours d'une réaction chimique, il est
nécessaire compte-tenu de leur faible durée de vie de les engendrer in situ par
rupture homolytique d'une liaison.
On peut
les obtenir :
- par thermolyse (action de la
chaleur)
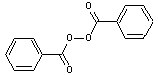
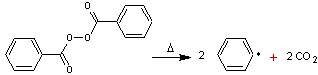
Exemples :
|
|
|
|
Thermolyse du peroxyde de benzoyle |
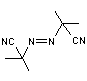
|
|
|
|
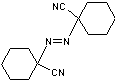
2,2'-Azobis(isobutyronitrile) ou AIBN |
Thermolyse de l'AIBN |
|
|
|
|
1,1'-Azobis(cyclohexane carbonitrile) |
Thermolyse du 1,1'-Azobis(cyclohexane
carbonitrile) |
Remarque : Les 3 molécules
citées sont des initiateurs de réactions radicalaires
; les deux derniers qui sont des composés azotés (azo) sont de plus en plus
utilisés au détriment des peroxydes dont la décomposition peut se révéler explosive.
- par photolyse (action de la
lumière)
Exemples :
|
|
|
|
Chlore |
Photolyse du chlore |
|
|
|
|
Disulfure de diphényle |
Photolyse du disulfure de diphényle |
1-2-3) Les additions radicalaires
En chimie organique, de nombreuses
réactions font intervenir des radicaux :
a)
Addition d'un halogénure d'hydrogène sur une double liaison
carbone-carbone
L'addition d'un halogénure
d'hydrogène sur une double liaison carbone-carbone peut se faire suivant
différents mécanismes selon les conditions opératoires ; en présence d'un
initiateur de radicaux par exemple le peroxyde de benzoyle ou le AIBN
(2,2'-Azobis Iso Butyro Nitrile) c'est une addition radicalaire qui a lieu :

Mécanisme
![]()
![]()
![]()
Cette addition est stéréosélective ;
l'atome de brome s'est fixé préférentiellement sur le carbone le moins
substitué (voir annexe 3).
b)
Les polymérisations par addition
Les polyéthylènes par exemple sont
obtenus par additions successives de molécules d'éthylène.
Ce sont des réactions en chaîne qui
comportent plusieurs étapes ; plusieurs types de mécanismes peuvent intervenir
et en particulier ceux mettant en jeu des radicaux on parle alors de
polymérisation radicalaire
La première étape s'appelle
l'initiation, elle nécessite un radical A* que l'on obtient grâce à un
initiateur (par exemple le peroxyde de benzoyle)
:
![]()
La deuxième étape s'appelle la
propagation
![]()
La troisième étape est l'arrêt
![]()
1-2-4) Les substitutions radicalaires
a)
Halogénation photochimique des alcanes
Cette réaction est radicalaire et en
chaîne :
-
Initiation
![]()
-
Propagation

-
Arrêt
![]()
ou
![]()
ou
![]()
b)
Halogénation photochimique des composés allyliques ou benzyliques
Composé allylique
![]()
Composé benzylique
![]()
cette stéréosélectivité très marquée
dans les deux cas est due à la forte stabilité par résonance des radicaux
|
|
|
1-2-5) Les cyclisations radicalaires
Un exemple
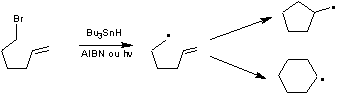
Remarque :
Bu3SnH correspond à
l'hydrure de tributylétain
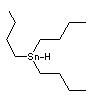
C'est une source d'atomes
d'hydrogène en synthèse organique ; il est utilisé soit avec l'AIBN soit avec
des UV qui permettent la formation des radicaux.
1-3) Les radicaux dans
l'atmosphère
L'atmosphère peut être séparée en
plusieurs zones (voir annexe 6) dont les deux plus proches de la Terre sont :
-
La troposphère qui se situe entre la surface de la Terre et l'altitude 15 km
environ (8 km au dessus des pôles et 16 km au dessus de l'équateur).
-
La stratosphère se situe au-delà de ces limites jusqu'à 50 km environ
d'altitude.
La séparation entre ces deux zones
s'appelle la tropopause.
La composition de l'air de la
troposphère est la suivante :
Outre de la vapeur d'eau en quantité
variable suivant l'altitude,
78,08%
de diazote N2
20,95% de dioxygène O2
0,93
% d'argon
On trouve aussi, à l'état de traces,
-
Des gaz à effet de serre : CO2, CH4, N2O, O3,
CO, CFC (Chlorofluorocarbures), COVNM (Composés organiques volatils autres que
le méthane) notamment (voir annexe 7).
- Des radicaux HO*, *NO, *NO2,
*NO3
Les oxydes d'azote (voir annexe 5) ont un rôle central dans la chimie atmosphérique.
1-3-1) Formation des principaux radicaux de l'atmosphère
-
Formation de HO* (radical hydroxyle)
C'est le principal oxydant diurne de
l'atmosphère ; sa durée de vie est très faible (de l'ordre d'une seconde) et il
ne peut donc s'accumuler.
Sa concentration moyenne diurne est
d'environ 2.106 molécules /cm3.
Sa principale source dans
l'atmosphère est
·
La
photolyse de l'ozone (un polluant de la troposphère)
![]()
![]()
Remarques :
v
O
(1D) est un des états excités de l'atome d'oxygène, à cette longueur
d'onde.
v
Une
importante proportion (90%) des O (1D) est ramenée à l'état
fondamental O (3P) par collision avec des molécules d'azote ou d'oxygène
(notées M) ; cet oxygène atomique dans l'état fondamental réagit avec l'oxygène
moléculaire pour reformer l'ozone
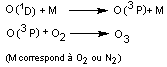
Mais HO*peut aussi se former en
quantité moindre par
·
Photolyse
du formaldéhyde (un autre polluant de l'atmosphère)
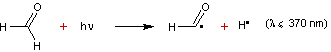
![]()
![]()
![]()
![]()
ou encore en quantité moindre également par
·
Photolyse
de l'acide nitreux (polluant de l'atmosphère)
![]()
-
Formation de *NO (radical monoxyde d'azote)
La réaction entre le diazote et le
dioxygène conduit à du monoxyde d'azote (NO), un gaz incolore.
Le bilan :
![]()
Ces réactions nécessitent de hautes
températures. On assiste à la formation de ce radical notamment quand la foudre
s'abat, lors de feux de forêts ou plus simplement par la combustion dans les
moteurs thermiques.
-
Formation de *NO2 (radical dioxyde d'azote)
A hautes températures le monoxyde
d'azote (NO) se transforme spontanément en dioxyde d'azote (NO2), un
gaz brun-rougeâtre.

Le bilan :
![]()
Le radical *NO2 se forme
dans les moteurs thermiques, les centrales électriques thermiques à charbon et
plus généralement dans beaucoup d'activités industrielles.
Remarque 1 :
NO2 formé est
en équilibre avec son dimère N2O4 un composé incolore
![]()
Plus la température est basse et
plus la proportion de N2O4 est élevée.
Remarque 2 :
Lorsqu'on parle de pollution
atmosphérique on cite parmi les polluants, les NOx qui correspondent
aux différents oxydes d'azote présents, NO, NO2, N2O, N2O4,
N2O3. Mais seuls les deux premiers sont couramment
analysés et mesurés.
-
Formation de ![]() (radical
nitrate)
(radical
nitrate)
Ce composé très fortement instable,
de couleur bleue n'a pas pu être isolé pur, mais a pu être observé en tant que
composant à très courte durée de vie dans différents systèmes gazeux ou
liquides.
![]() a pour structure
a pour structure
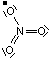 ou
ou ![]()
avec possibilité de résonance entre les trois oxygènes
Il est le principal oxydant nocturne de l'atmosphère ; sa concentration
moyenne est d'environ 106 molécules/cm3.
Sa source principale correspond à la réaction entre l'ozone et le dioxyde
d'azote
![]()
Mais il peut aussi se former par décomposition thermique du pentoxyde de
diazote (N2O5)
![]()
M représente des molécules de diazote ou de dioxygène avec lesquelles se
produisent des collisions.
1-3-2) Rôle des radicaux hydroxyle et nitrate dans l'atmosphère
Ainsi qu'il a été dit précédemment, ces deux radicaux sont des radicaux
oxydants qui interviennent, l'un essentiellement le jour (HO*), l'autre
principalement la nuit (NO3*) mais avec des cinétiques d'oxydation
différentes, plus lente pour le radical nitrate ; il ne faut pas oublier
l'ozone qui bien que n'étant pas un radical participe lui aussi aux propriétés
oxydantes de l'atmosphère, de jour comme de nuit, mais avec des cinétiques
lentes.
C'est surtout la capacité en radical hydroxyle (HO*) de l'atmosphère qui
définit sa capacité oxydante.
Ils agissent sur les principaux polluants de l'atmosphère et les
transforment.
·
Radical hydroxyle
il agit sur les COV , notamment le méthane et le monoxyde de carbone.
On va donner les premières étapes de l'action des radicaux HO* ; les
composés formés subiront ensuite d'autres transformations ….
v Avec les alcanes :
![]()
![]()
Ce radical peroxyle réagit sur du monoxyde d'azote :
- Si la concentration de
celui-ci est suffisante
Ecrivons
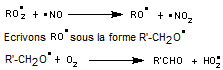
R' correspond à R amputé d'un carbone.
Exemple : avec le méthane
![]()
![]()
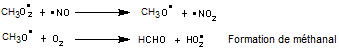
- Si la concentration en
monoxyde d'azote est faible
R' correspond à R amputé d'un carbone.
v Avec les alcènes
Prenons l'exemple de l'éthylène
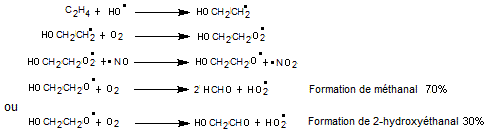
·
Radical nitrate
il agit sur les COV notamment d'origine naturelle principalement la nuit.
- Soit par arrachement d'un hydrogène
Le radical R* réagit ensuite de la même façon que ceux produits avec le
radical hydroxyle (voir ci-dessus).
- Soit par addition sur une double liaison
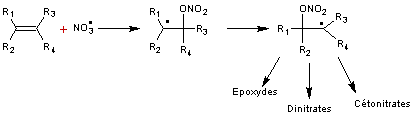
Exemple : action du radical nitrate sur l'isoprène un COV d'origine
naturel, fréquent
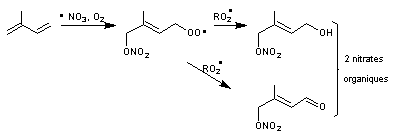
Les nitrates organiques ont des
durées de vie de plusieurs dizaines de jours ; de ce fait ils peuvent être
transportés hors de leur zone de production ; ils libèrent des NOx.
Les nitrates organiques ont une
toxicité élevée pour l'homme (atteintes cardio-vasculaires).
1-4) Les radicaux et le vivant
Les radicaux ont en général une très
grande réactivité ; ils sont impliqués dans les dégradations oxydatives des
aliments qui entrainent des modifications au niveau sensoriel et nutritionnel
de ceux-ci.
D'un point de vue médical ils
participent à certains phénomènes de vieillissement et leur accumulation dans
l'organisme est suspectée d'entraîner des maladies comme par exemple
l'athérosclérose.
1-4-1) Les espèces réactives de l'oxygène (ERO)
Cette appellation regroupe :
-
des radicaux :
|
|
|
HO2* |
|
|
Radical
superoxyde |
Radical
hydroxyle |
Radical
perhydroxyle |
Monoxyde
d'azote |
……..
mais aussi
-
des non radicaux :
|
H2O2 |
ONOO- |
O3 |
1O2 |
|
Peroxyde
d'hydrogène |
Ion
peroxynitrite |
Ozone |
L'oxygène
singulet (voir
annexe 8) |
……..
On appelle stress oxydant pour un
organisme un type d'agression des constituants des cellules par des espèces
réactives oxygénées (ERO).
La majeure partie de de l'oxygène
que nous respirons est transformé en eau dans notre organisme par réduction
(addition de 4 électrons), réaction catalysée par la cytochrome oxydase :
![]()
2% environ de l'oxygène respiré subit une autre réduction, monoélectronique
celle là, conduisant à la formation du radical superoxyde au niveau du coenzyme
Q :
![]()
L'oxygène peut aussi être réduit par
deux électrons (en présence d'oxydase) pour donner de l'eau oxygénée :
![]()
La toxicité de l'eau oxygénée
provient de sa capacité à générer le radical hydroxyle HO* ; en effet ce
radical est particulièrement délétère pour les les matériaux biologiques ; en
présence d'ions Fe2+ l'eau oxygénée donne ce radical par une
réaction dite de Fenton :
![]()
En fonctionnement normal,
l'organisme possède des mécanismes capables de contenir et réguler la
production de ces radicaux ; dans certaines circonstances cependant, il
apparaît un déséquilibre soit par production exagérée de radicaux, soit par
insuffisance des mécanismes de défense ou les deux à la fois, on a alors à
faire à un état de stress oxydant.
-
Les radicaux hydroxyle HO* sont les plus redoutables car ils attaquent
tous les "matériaux" biologiques très rapidement (ADN, protéines,
lipides …).
Trois modes d'action principaux :
-
En arrachant un électron
![]()
-
En arrachant un hydrogène
![]()
Exemple :
Le radical HO* arrache un hydrogène à un lipide et initie une réaction en
chaîne qui peut aboutir à un alcool (peroxydation lipidique)
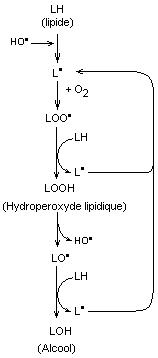
Cette peroxydation des lipides est dangereuse pour les cellules et induit
par exemple une diminution de la fluidité des membranes plasmiques et perturbe
les membranes des organites cellulaires.
- En s'additionnant sur
une double liaison
![]()
Exemple :
Le radical HO* réagit avec les bases
de l'ADN en s'additionnant sur les doubles liaisons (ici la guanine)
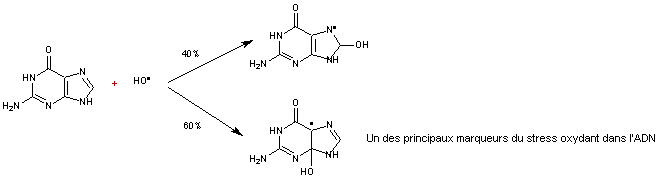
La conséquence est qu'au lieu de
s'apparier avec la cytosine, la molécule formée s'associera avec l'adénine,
entraînant des mutations au sein de l'ADN et conduisant à des altérations du
message génétique impliquées dans le déclenchement du cancer et dans le
vieillissement.
-
Les radicaux superoxydes O2*-
Ils sont assez peu réactifs
vis-à-vis de la plupart des substrats bioorganiques ; ils ont surtout un effet
indirect ; ils réagissent sur l'eau oxygénée et conduisent au radical hydroxyle
HO* ; c'est la réaction de Haber-Weiss :
![]()
C'est ce radical qui se montre
délétère.
1-4-3) Des effets bénéfiques des radicaux
Les ERO n'ont pas que des effets
nuisibles sur l'organisme.
On peut citer parmi les fonctions
physiologiques à composante radicalaire, la régulation du tonus vasculaire, la
relaxation du muscle lisse, l'adhésion plaquettaire …Et surtout la défense
antimicrobienne (bactéricidie dépendante de l'oxygène).
Ces réactions biologiques sont
complexes et ne feront pas l'objet d'un développement.
Certaines substances
intracellulaires luttent contre le stress oxydant en s'opposant à l'action
délétère des radicaux. Elles se composent
v
de
systèmes enzymatiques endogènes comme les superoxydes dismutases, les
peroxydases …
- Les superoxydes dismutases sont présentes en
particulier chez les mammifères ; elles provoquent la dismutation de deux
anions superoxydes O2* -
![]()
et formation d'eau oxygénée et d'oxygène moléculaire
- Les
glutathion peroxydases (GPX) sont des enzymes à sélénium utilisant un
cofacteur le glutathion réduit (GSH) (voir annexe 9) et réduisant les
radicaux peroxyles, les hydroperoxydes (en particulier les lipoperoxydes) et
même l'eau oxygénée (peroxyde d'hydrogène).
![]()
![]()
![]()
v
de
molécules anti-oxydantes le plus souvent d'origine exogène :
-
Vitamine E :
C'est un mélange de substances de
structures voisines, les tocophérols a, b, g, d.
Elle se présente comme une huile
épaisse ; elle n'est pas ou peu métabolisée dans l'organisme. On la trouve dans
les huiles de germes de blé, de céréales en général, de tournesol, de colza ….
C'est une vitamine liposoluble.
|
|
|
|
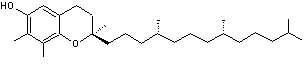
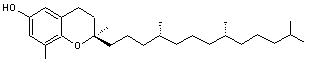
Alpha-tocophérol |
Bêta-tocophérol |
|
|
|
|
Gamma-tocophérol |
Delta-tocophérol |
C'est la molécule de
γ-tocophérol qui est biologiquement la plus active mais c'est la molécule d'α-tocophérol qui est la plus abondante.
Mode d'action :
Elle stoppe le mécanisme de
propagation de la chaîne d'oxydation en réduisant les intermédiaires
radicalaires. La vitamine C régénère ensuite la vitamine E à la surface des
membranes cellulaires.
Ainsi avec un lipide LH nous aurons
:

-
Vitamine A ou vitamine A1 ou
rétinol
C'est une vitamine liposoluble qui
intervient dans le métabolisme des lipides et des protéines. Elle est
nécessaire à la formation du pourpre rétinien ; elle intervient donc dans le
mécanisme de la vision ; sa formule est
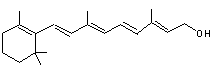
Elle fut la première vitamine
liposoluble découverte par Mac Collum, Davis, Osborne et Mendel en 1913.
Le potentiel antioxydant de la
vitamine A a été décrit la première fois par Monaghan et Schmitt deux chimistes
qui en 1932 montrèrent que la vitamine A inhibait l'oxydation de l'acide
linoléique (empêchait son rancissement).
Le mécanisme d'action de cette activité
vis-à-vis des radicaux est la suivante :

Les radicaux lipoperoxyles LOO* sont
neutralisés.
-
Les caroténoïdes
Certains d'entre eux sont des
provitamine A, c'est-à-dire qu'ils se transforment dans l'organisme en vitamine
A ; c'est le cas du β-carotène
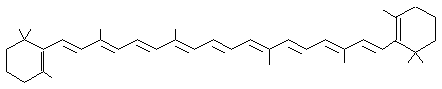
Ils possèdent donc comme celle-ci un
potentiel anti-radicaux.
-
Vitamine C (Acide ascorbique)
·
Elle
permet de régénérer la vitamine E dans les membranes des cellules comme on
vient de le voir plus haut, sous forme d'ion ascorbate.
·
C'est
aussi un des anti-radicaux sous forme de radical ascorbate en donnant un
électron aux radicaux lipoperoxyles et en mettant ainsi fin à la réaction en
chaîne de peroxydation des lipides.
![]()
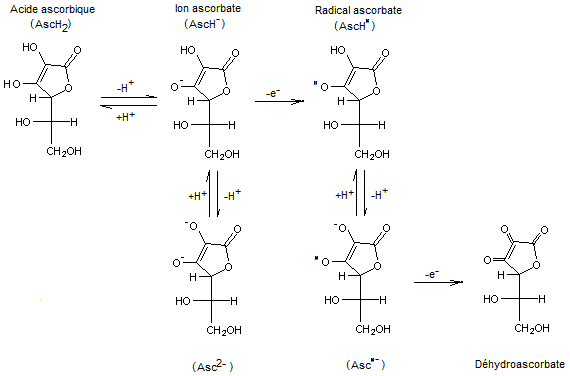
Remarque : Suivant les conditions de pH et la présence de métaux de
transition la vitamine C peut aussi se comporter comme un pro-oxydant,
générateur de radicaux libres, notamment à forte concentration.
-
Polyphénols
Il s'agit d'une grande famille de
molécules organiques qui ont en commun la présence d'au moins deux groupes
phénoliques.
Ils sont très largement présents
dans le règne végétal ; on connaît bien par exemple les flavonoïdes dont les anthocyanes font
partie.
Les polyphénols piègent certains
radicaux :
Les radicaux superoxydes O2*
-, peroxyles (ROO*), alkoxyles (RO*), hydroxyles (HO*).
Exemple du catéchol :
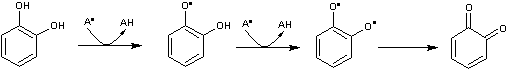
Exemple de la quercétine :
C'est un flavonoïde qui a un rôle protecteur de l'ADN en neutralisant les
radicaux HO*, O2*- notamment.
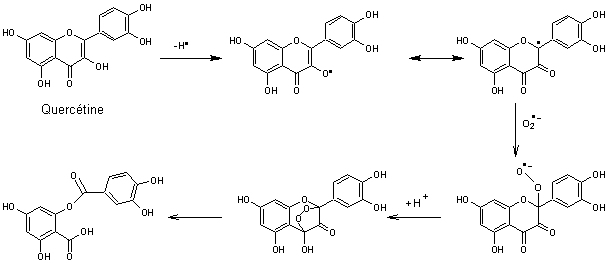
Remarque : La quercétine est aussi accusée d'être un agent carcinogène. En effet
suivant la concentration en ions Cu2+ du milieu elle peut :
- soit avoir un rôle protecteur (Concentration en Cu2+≤
25 µmol/L)
- soit faire subir des dommages à l'ADN (Concentration
en Cu2+≥ 25 µmol/L)
Une évaluation possible du pouvoir
antioxydant d'un composé phénolique
Le 2,2-Diphényl-1-picrylhydrazyle ou DPPH* radical
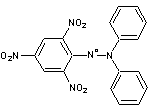
est un radical relativement stable, de couleur violette qui devient jaune
par réduction (il devient du DPPH-H).
Le test DPPH* permet de mesurer l'aptitude d'un antioxydant comme par exemple un
composé phénolique à réduire le DPPH* et mesure donc le pouvoir
antiradicalaire de molécules ou d'extraits végétaux dans un système donné.
Test DPPH*
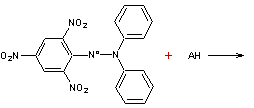
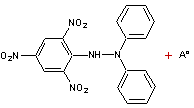
On peut apprécier la réduction du DPPH* par spectrométrie à 517 nm.
Définition
d'une entité moléculaire
On appelle entité moléculaire,
tout atome, molécule, ion, paire d’ions, radical, diradical, ion radical,
complexe, conformère, etc., bien défini chimiquement ou isotopiquement et
pouvant être identifié individuellement.
Gomberg
et les radicaux
En
voulant synthétiser l'hexaphényléthane composé hypothétique qui aurait comme
formule
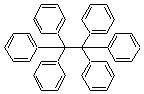
par couplage de Wurtz d'un halogénure
de triphénylméthane
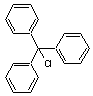
Gomberg
isola un produit qui se révéla être un peroxyde
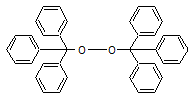
Il en
déduisit l'existence d'une espèce radicalaire qui, en réagissant rapidement
avec l'oxygène de l'air conduisait à ce peroxyde
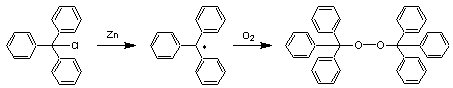
Gomberg
pensait que ce radical était en équilibre avec un autre produit solide jaune,
stable plusieurs heures, qu'il obtenait dans sa préparation et qu'il supposait
être l'hexaphényléthane recherché.
En fait
l'analyse par cristallographie aux rayons X de ce solide montra qu'il
s'agissait du composé suivant
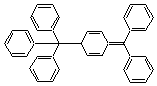
auquel
on donna le nom de dimère de Gomberg et qui se dissocie en partie dans un
solvant organique en donnant deux radicaux triphénylméthyle
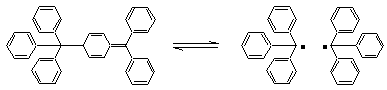
L'expression
"radical libre" (que l'on n'utilise plus de nos jours et qui est
remplacée par radical), est apparue en 1900 pour la première fois dans une publication de Gomberg dans le JACS
(Journal of the American Society).
Cette
découverte permit d'expliquer l'addition anti-Markovnikov de H-Br sur un alcène
appelée effet
Kharasch et de nombreux autres phénomènes biologiques impliquant
l'intervention de radicaux.
Stéréosélectivité de l'addition d'un
halogénure d'hydrogène sur une double liaison carbone-carbone
Il a été précisé que si cette
addition est faite en présence d'un peroxyde, l'atome de brome se fixe
préférentiellement sur le carbone le moins substitué :
![]()
Lors de l'étape
![]()
c'est le radical le plus substitué
qui se forme de préférence car il est plus stable que le radical primaire
![]()
Ce deuxième radical se forme aussi
mais en petite quantité et conduit à l'isomère
![]()
C'est pourquoi on dit que la
réaction est stéréosélective et non stéréospécifique.
Remarque :
En dehors de tout initiateur
radicalaire, on obtiendrait une addition électrophile et c'est l'isomère
![]()
qui serait prépondérant.
C'est le chimiste Kharasch qui le premier a
expliqué cela et c'est pourquoi on a donné le nom d'effet Kharasch à ce
phénomène.
Différents types de radicaux
|
|
|
|
X
= groupes électro-attracteurs |
|
Orbitale
p |
Orbitale
hybridée sp2 |
Orbitale
hybridée sp |
Orbitale
hybridée sp3 |
|
Radical
de type p |
Radical
de type σ |
Radical
de type σ |
Radical
de type σ |
Des généralités sur les oxydes
d'azote
Il existe 6 oxydes d'azote connus,
la valence de l'azote variant de +1 à +5
|
Valence de l’azote |
Formule |
Appellation |
État |
|
|
+1 |
N2O |
Protoxyde
d’azote (gaz hilarant) |
gazeux |
|
|
+2 |
NO |
Monoxyde d’azote |
Réaction rapide avec des traces d’
O2 ; on obtient NO2 |
gazeux |
|
+3 |
N2O3 |
Trioxyde de diazote |
Anhydride de l’acide nitreux |
gazeux |
|
+4 |
NO2 |
Dioxyde d’azote |
Anhydride mixte d’acide nitreux et
d’acide nitrique (dismutation) |
gazeux (roux) |
|
+4 |
N2O4 |
Tétroxyde de diazote |
Anhydride mixte d’acide nitreux et
d’acide nitrique (dismutation) |
liquide jaune (20°C) |
|
+5 |
N2O5 |
Pentoxyde de diazote |
Anhydride de l’acide nitrique |
solide (incolore) |
·
Dans l'atmosphère, dans l'air, l'azote (78%) et l'oxygène
(21%) coexistent dans les conditions normales (pression 1 atmosphère et
température 20°C) sans qu'aucune réaction ne soit observée.
·
Les oxydes d’azote sont des composés
endothermiques. NO et NO2 se forment sous l'effet des éclairs au moment
des orages.
·
N2O4 a une température de
fusion de -11°C et une température d'ébullition de + 21°C. C'est pourquoi à la
température ordinaire de 20°C il se présente comme un liquide incolore déjà
teinté par une petite quantité de NO2.
Les différentes "couches de
l'atmosphère"

COV, COVNM
·
COV
On définit depuis 1999 en
Europe les Composés Organiques Volatils
de la façon suivante :
" Tout composé organique ayant une
pression de vapeur de 0,01 kPa ou plus à une température de 293,15 K ou ayant
une volatilité correspondante dans les conditions d'utilisation
particulières."
Ils sont émis dans l'atmosphère
-
soit de façon naturelle (composés biogéniques) : plantes, zones géologiques
contenant charbon ou gaz) pour environ 90% des émissions
-
soit de façon anthropique (c'est-à-dire due à l'activité de l'homme) pour
environ 10% des émissions.
On peut citer comme exemple et en
les classant par ordre croissant de réactivité :
-
Les alcanes complètement halogénés
-
Les alcanes partiellement halogénés
-
Les alcanes
-
Les cétones, les alcools, les éthers, les esters,
-
Les composés aromatiques , les aldéhydes
-
Les alcènes
-
Les terpènes
·
COVNM
Ce sont les composés organiques
volatils non méthaniques
L'oxygène singulet
L'oxygène singulet est une forme
particulière d'oxygène qui peut être engendrée par action d'un sensibilisateur
sur l'oxygène ordinaire. Un sensibilisateur peut être un composé absorbant
l'énergie lumineuse dans un domaine de longueur d'onde assez étroit et donnant
lieu à une émission de fluorescence.
Soit S la molécule de
sensibilisateur.
Sous l'effet d'un laser, cette
molécule est excitée
![]()
Elle transmet son excès d'énergie à
l'oxygène ordinaire O2 qui prend alors la forme particulière
d'oxygène singulet.
On écrit

Le diagramme des orbitales du
dioxygène O2, au niveau 2p est le suivant

Le transfert d'énergie par le
sensibilisateur excité a pour effet de modifier la répartition des électrons
des orbitales πx et πy.
Il y a un retournement de spin
donnant
![]()
On dit que la molécule d'oxygène
ordinaire est dans un état triplet parce que, à cause des spins s = +1/2 et s =
+1/2 des électrons des orbitales πx et πy la
quantité 2s+1 de la règle de quantification est égale à 3 et on adopte la
notation (3)O2.
La perturbation, en créant les spins
s = +1/2 et s = -1/2 entraîne 2s+1 = 1. On écrit (1)O2 et
on parle d'état singulet.
Le glutathion
Le glutathion est le tripeptide g-glu-cys-gly
(le sigle g-devant
glu indique que c’est, dans le cas de l’acide glutamique, l’acide à l’extrémité
de la chaîne qui est engagé dans la liaison peptidique) ; il est présent dans
les cellules vivantes et joue le rôle d’agent de réduction des processus
biochimiques en se laissant facilement oxyder, par voie enzymatique, au niveau
du groupe mercapto (-SH) en un dimère avec pont disulfure (-S-S-).
Découvert par Hopkins en 1921. Composé
strictement intracellulaire chez les mammifères, il est largement répandu. Son
rôle physiologique est multiple (protection des composés oxydables contre
l'oxydation due aux peroxydes, il permet également la formation des leucotriènes).
Deux formes: la forme oxydée (deux molécules de glutathion reliées par un pont
disulfure, et la forme réduite).
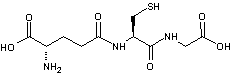
Glutathion (forme réduite)
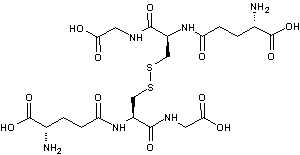
Glutathion (forme oxydée)