EVALUATION
DU POUVOIR ANTIOXYDANT
Gérard Gomez
Plan de l'étude
1) Introduction
2) Tests d'évaluation du pouvoir antiradicalaire
2-1)
Test DPPH
2-3)
Test ORAC
2-4)
Test FRAP
Annexe 1 Le trolox
Annexe 2 La
fluorescéine
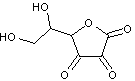
ANNEXE 3 Produits de dégradation de la
fluorescéine en présence de AAPH
Annexe 4 L'acide
ascorbique
1) Introduction
Selon
le règlement européen CE/1333/2008 , les antioxydants sont "des substances
qui prolongent la durée de conservation des denrées alimentaires en les
protégeant des altérations provoquées par l'oxydation telles que le
rancissement des matières grasses et les modifications de la couleur".
Ce sont
en général des radicaux possédant une très grande réactivité et présents dans
l'air qui sont impliqués dans les dégradations oxydatives des aliments et qui
entrainent des modifications au niveau sensoriel et nutritionnel de ceux-ci.
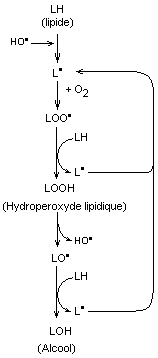
Un
exemple
de mécanisme d'altération d'un lipide à l'air par un radical HO* :
Le
radical arrache un hydrogène à un lipide et initie une réaction en chaîne qui
peut aboutir à un alcool (peroxydation lipidique)
|
|
Certains
antioxydants (dits antiradicalaires) que nous désignerons par AH bloquent les
radicaux lipidiques par transfert d'un hydrogène et empêchent la réaction en chaîne :
|
Ce sont
les espèces réactives de l'oxygène (ERO)
qui entraînent cette altération des aliments.
Parmi
elles le radical hydroxyle HO*est le plus actif donc le plus délétère pour les
matériaux biologiques. Le radical superoxyde O2* - est assez peu
réactif vis-à-vis de la plupart des substrats bioorganiques, il a surtout un
effet indirect en conduisant au radical HO*.
Parmi
les antiradicaux on peut citer les polyphénols :
Exemple
du catéchol
Considérons
un composé BH susceptible d'être transformé en B* par une espèce réactive de
l'oxygène. Il peut être protégé par le catéchol qui lui fournit un hydrogène et
lui permet de redevenir BH au lieu d'être oxydé.
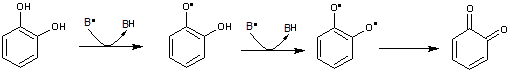
Il
existe plusieurs types de systèmes antioxydants :
- Les enzymes antioxydantes :
superoxydes dismutase, glutathion peroxydase, catalase …..
- Des molécules à haut poids
moléculaire : albumine, ferritine et autres protéines.
- Des molécules de plus petites
tailles : acide ascorbique, acide urique, tocophérol, caroténoïdes, polyphénols
….
- Certaines hormones : oestrogènes,
mélatonine ….
Les
antioxydants peuvent désactiver les radicaux par deux mécanismes principaux :
- Transfert d'hydrogène (HAT Hydrogène Atom
Transfer)
![]()
- Transfert d'électron (SET Single Electron
Transfer).
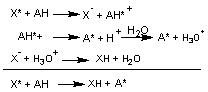
SET et
HAT ont lieu la plupart du temps ensemble dans les échantillons.
2) Tests d'évaluation du pouvoir antiradicalaire
Plusieurs
méthodes ont été développées pour la détection de l'activité antioxydante.
2-1) Test DPPH*
Le
2,2-Diphényl-1-picrylhydrazyle ou DPPH* radical
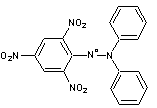
est un
radical relativement stable, de couleur violette qui devient jaune par
réduction (il devient du DPPH-H).
Le test
DPPH* permet de mesurer l'aptitude d'un antioxydant comme par exemple un
composé phénolique à réduire le DPPH* et mesure donc le pouvoir
antiradicalaire de molécules ou d'extraits végétaux dans un système donné.
Principe
du test
On fait
réagir une solution contenant l'antioxydant (molécule pure ou extrait) AH avec
une solution de DPPH*

On peut
apprécier la réduction du DPPH* par spectrométrie à 517 nm.
Cette
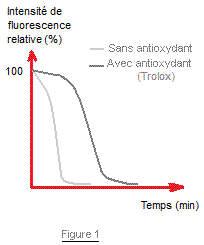
réduction sera plus ou moins rapide selon la nature de l'antioxydant (figure 1)
et la quantité de DPPH-H formé dépendra de la concentration en antioxydant
(figure 2).
|
|
|
|
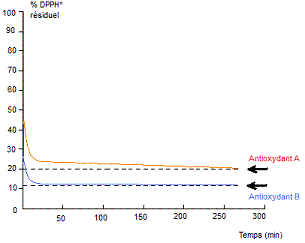
Cinétique de réduction de DPPH*
pour deux antioxydants |
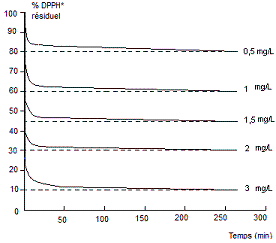
Cinétique
de réduction de DPPH* pour un antioxydant à différentes concentrations. |
|
Figure
1 |
Figure 2 |
|
|
Figure 1 On trace la courbe cinétique de
réduction d'une même quantité de DPPH* pour deux antioxydants, on s'aperçoit
qu'elles ne sont pas identiques : L'oxydant B agit plus vite que le A et le %
résiduel de DPPH* au plateau est plus faible. Figure 2 On trace la courbe cinétique de
réduction d'une même quantité de DPPH* pour un même antioxydant à différentes
concentrations : Plus la concentration augmente plus la réaction est rapide et
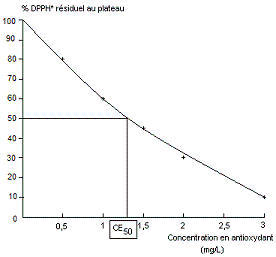
plus le % résiduel de DPPH* est faible au plateau. Figure 3 On trace la courbe du % résiduel de
DPPH* au plateau, en fonction de la concentration en antioxydant (courbe
effet-dose) et on détermine le CE50. |
|
Courbe
Effet-Dose – Détermination du CE50 |
|
|
Figure 3 |
|
La concentration
efficace en antioxydant nécessaire pour réduire 50% du DPPH* initial est
notée CE50 ; elle est dans notre exemple de 1,35 mg/L
environ (voir figure 3).
Plus le
CE50 est faible et plus l'antioxydant est efficace.
Remarques :
- On définit l'efficacité
antiradicalaire (Antiradical Efficiency) et on la désigne par AE50,
l'expression AE50 = 1/EC50 ; on voit que plus AE50
est grande et plus l'antioxydant est efficace.
- Le pouvoir antioxydant d'une
substance n'a pas de sens en valeur absolue ; le plus souvent on l'exprime en
valeur relative en prenant comme référence une substance donnée à fort effet
antioxydant ; c'est souvent le Trolox (voir annexe 1).
La capacité antioxydante en équivalent Trolox (TEAC) correspond à la
concentration (mg/L) de Trolox ayant la même activité que la solution de la
substance à tester à concentration unitaire.
2-2) Test
utilisant l'ABTS*+
C'est
une méthode semblable à celle utilisant le radical DPPH*+.
Il permet
de voir quelle est la capacité des antioxydants à neutraliser le radical ABTS*+.
L'ABTS
est l'acide 2,2'-azino-bis(3-éthylbenzothiazoline-6-sulfonique)
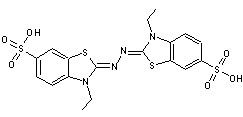
ABTS*+
peut être généré
- par des réactions chimiques
(action du persulfate de potassium par exemple)
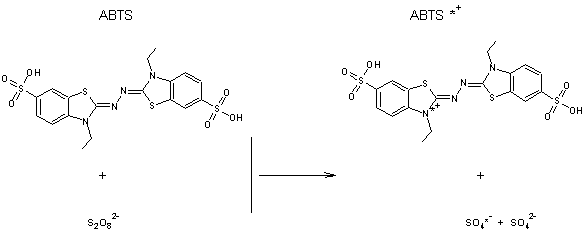
Ce
processus de production du radical ABTS*+ est assez lent et
nécessite un léger chauffage.
- par des réactions enzymatiques
On peut
utiliser de la raifort peroxydase par exemple en présence d'eau oxygénée (H2O2).
Généralement
ces réactions enzymatiques sont plus rapides et plus douces.
En
présence d'un antioxydant donneur de H*
(comme le trolox par exemple), l' ABTS*+ est réduit en ABTSH+ :

Le
radical cationique ABTS*+ est de couleur bleue avec un pic
d'absorption à 734 nm. Il réagit avec la plupart des antioxydants, notamment
les phénols, les thiols ou la vitamine C en perdant sa couleur bleue et en
retrouvant son état neutre incolore. On peut donc suivre ces réactions par
spectrophotométrie.
Cette
mesure permet de comparer le pouvoir antiradicalaire de différents antioxydants
par rapport à celui du Trolox pris comme référence ; La capacité
antioxydante en équivalent Trolox (TEAC) correspond à la concentration
(mg/L) de Trolox ayant la même activité que la solution de la substance à
tester à concentration unitaire.
2-3) Test ORAC
L'évaluation
du pouvoir antioxydant d'une substance peut se faire par la méthode ORAC (Oxygen Radical
Absorbance Capacity : Capacité d'absorption des radicaux dérivés de l'oxygène) dont le principe
est le suivant :
On met
en présence une sonde fluorescente sensible à l'oxydation (la fluorescéine (voir annexe
2) :
excitation 487 nm , émission 515 nm) et un générateur de radicaux, par exemple
le chlorhydrate de 2,2'-azobis(2-amidinopropane) ou AAPH un composé oxydant
thermolabile qui donne à 37°C des radicaux peroxyles (R-O-O*) ; l'oxydation de
la fluorescéine entraîne une diminution de sa fluorescence au cours du temps
(figure 1 …"Sans antioxydant").
Le
chlorhydrate de 2,2'-azobis(2-amidinopropane) ou AAPH a pour formule
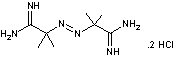
En
présence d'oxygène et chauffé à 37°C, il donne des radicaux peroxyles :
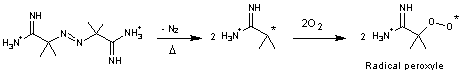
La présence
d'un antioxydant retarde la perte de fluorescence (Figure1).
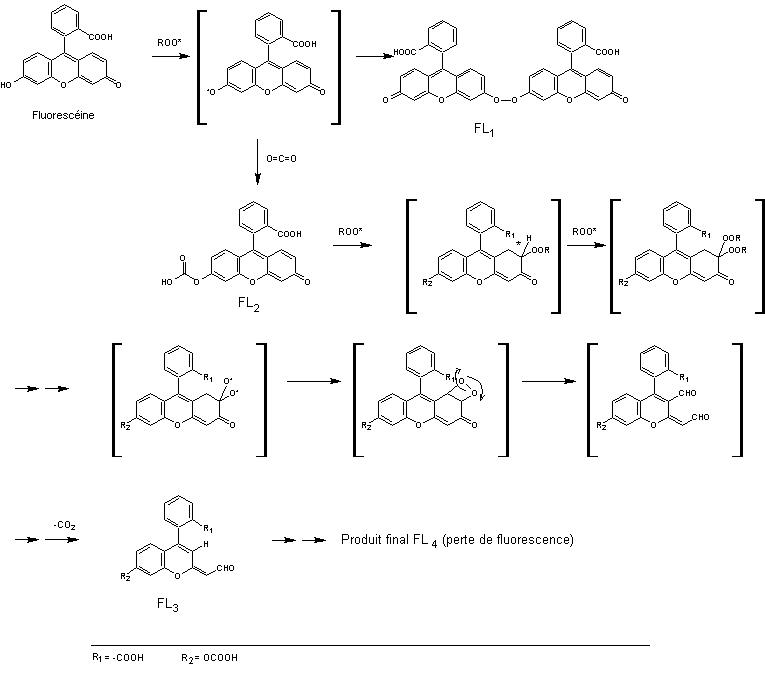
La
fluorescéine donne des produits de dégradation (voir annexe
3).
Pour
quantifier le pouvoir antioxydant d'une substance on peut comparer son effet
sur l'intensité relative de fluorescence de la sonde en fonction du temps à
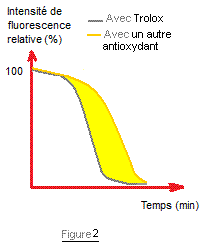
l'effet d'une substance de référence (on prend souvent le Trolox) (Figure 2).
|
|
|
Le
potentiel antioxydant est déterminé par la différence d'aire sous la courbe de
l'antioxydant évalué, avec l'aire sous la courbe du Trolox (surface en jaune
dans la figure 2) ; il est exprimé en concentration équivalente de Trolox ; 1
unité ORAC équivaut à 1 µmole de Trolox par g ou pour 100g (extraits et fruits)
ou 1 µmole de Trolox par µmole de composé pur.
Ce test
est applicable sur les végétaux (plantes, fruits, légumes) et leurs produits
dérivés.
Plus l'indice
ORAC est élevé et plus la substance a un pouvoir antioxydant élevé.
Quelques
valeurs d'indice ORAC pour quelques substances :
|
Substances |
Indice
ORAC en
µmol TE/100g |
Substances |
Indice
ORAC en
µmol TE/100g |
Substances |
Indice
ORAC en µmol
TE/100g |
|
Haricots |
8033 |
Noix |
13541 |
Clou
de girofle (poudre) |
290283 |
|
Lentilles |
7282 |
Prunes |
6100 |
Cannelle |
267536 |
|
Choux |
1359 |
Grenades |
4479 |
Persil |
74349 |
|
Tomates |
337 |
Pommes |
3898 |
Cacao
(poudre) |
55653 |
|
Concombres |
140 |
Oranges |
2103 |
Poivre |
27618 |
Remarque :
L'USDA
(département de l'agriculture des Etats-Unis) a publié une liste de 326
aliments avec des indices ORAC rapportés à 100g de matière. Cette liste a été retirée
quelques temps après, en révélant qu'il n'y avait pas de preuves scientifiques
sur la corrélation entre l'action antioxydante et les
effets bénéfiques attribués aux substances individuelles.
2-4) Test FRAP (Ferric
Reducing Antioxydant Power)
C'est une méthode colorimétrique de transfert d'électrons (SET)
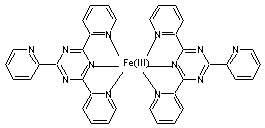
permettant de mesurer la capacité d'un antioxydant à réduire le complexe
ferrique-tripyridyltriazine Fe(III) (TPTZ)2 de couleur jaune en
cation ferreux- tripyridyltriazine fe(II)(TPTZ)2 de couleur bleue,
qui absorbe à 593 nm.
|
|
|
|
Complexe Fe(III)(TPTZ)2 |
Complexe fe(II)(TPTZ)2 |
La réaction correspond à :
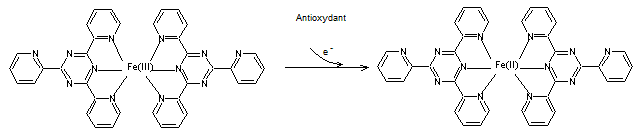
La valeur d'absorbance obtenue par spectrophotométrie permet de
corréler la quantité de fer réduite (obtenue par étalonnage avec des solutions
de fer(II)) avec la quantité d'antioxydant. Le Trolox ou l'acide ascorbique (annexe 4) sont utilisés comme références.
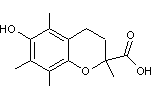
Le trolox
|
ou Acide 6-hydroxy-2,5,7,8-
tétraméthylchromane-2- carboxylique. C14H18O4 Masse molaire 250,290 g.mol-1 Solubilité Soluble dans l'eau N° CAS 53188-07-1 |
Le trolox |
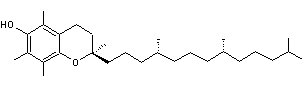
L'α-tocophérol |
Cette molécule est
un analogue de l'α-tocophérol, un des constituants de la vitamine E ; elle
est soluble dans l'eau et possède un fort effet antioxydant.
C'est un inhibiteur
des dommages occasionnés par l'oxydation sur les membranes des cellules.
On s'en sert comme
référence pour estimer la capacité antioxydante d'une substance (TEAC).
ANNEXE 2
La fluorescéine
Matière colorante obtenue par déshydratation d'un mélange d' anhydride phtalique et de résorcinol. Elle se présente sous
forme d'une poudre rouge, qui donne à l'eau une couleur "vert fluo"
même à l'état de trace.

L'acide ascorbique
L'acide ascorbique est un réducteur, sa fonction énol étant très
oxydable.
Lorsqu'il a été oxydé il devient l'acide déhydroascorbique (Dha):